
【题目】将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸的体积有如图所示的关系(不考虑CO2在水中的溶解)。下列说法不正确的是( )
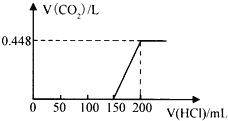
A. 滴加盐酸0→150mL段发生的反应依次为OH-+H+=H2O、CO32-+H+=HCO3-
B. 所用盐酸的物质的量浓度为0.4 molL﹣1
C. CO2体积不再改变时,溶液中的溶质为NaCl
D. 该样品中NaOH与Na2CO3物质的量之比为1:2
【答案】D
【解析】
A、因为碳酸钠与盐酸反应生成碳酸氢钠,与碳酸氢钠与盐酸反应生成二氧化碳消耗盐酸的物质的量相等,所以由图可知V(HCl)在0~100mL区间内发生反应的化学方程式为:NaOH+HCl=NaCl+H2O;在100~150mL区间内发生反应的化学方程式为Na2CO3+HCl=NaCl+NaHCO3;在150~200mL区间内发生反应的化学方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,离子反应依次是:OH-+H+=H2O、CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O,故A正确;
B、加入150mL~200mL盐酸,消耗盐酸体积=200mL-150mL=50mL,生成0.448L二氧化碳,其物质的量=0.448L÷22.4L/mol=0.02mol,则根据方程式NaHCO3+HCl=NaCl+CO2↑+H2O可知消耗盐酸的物质的量是0.02mol,则c(HCl)=0.02mol÷0.05L=0.4mol/L,故B正确;
C、加入200mL盐酸时,生成0.448L二氧化碳,此时溶液中溶质为NaCl,故C正确;
D、加入200mL盐酸时,生成0.448L二氧化碳,此时溶液中溶质为NaCl,由氯离子守恒可知n(NaCl)=0.2L×0.4mol/L=0.08mol,根据碳元素守恒n(Na2CO3)=n(CO2)=0.02mol,根据钠离子守恒n(NaOH)=n(NaCl)-2n(Na2CO3)=0.08mol-0.02mol×2=0.04mol,故该样品中NaOH与Na2CO3物质的量之比=0.04mol:0.02mol=2:1,故D错误。
故答案选D。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 向氯化铁溶液中加入过量的硫化钠:2Fe3++S2- = 2Fe2++S↓
B. 氢氧化铁溶于氢碘酸溶液:Fe(OH)3+ 3H+ = Fe3++ 3H2O
C. 硫酸铝溶液中加入过量氨水:Al3++ 4 NH3·H2O=AlO2- +4 NH![]() + 2 H2O
+ 2 H2O
D. 向NaHSO4溶液滴加Ba(OH)2溶液至中性:2H++SO42-+ Ba2++ 2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在-50℃时液氨中存在着下列平衡:2NH3(液)![]() NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
A. 离子积为1.0×10-15
B. 离子积为1.0×10-30
C. 向液氨中加入氨基钠(NaNH2),液氨的离子积增大
D. 向液氨中加入NH4Cl,c(NH4+)增大,离子积的数值也随之增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示。请回答下列问题:

(1)装置B的作用是________________。
(2)装置C中发生反应的离子方程式是_____________________________。
SO2在装置D中完全转化为酸式酸根离子的过程中,溶液颜色变化是________。
(3)已知酸性:HCl>H2SO3>HClO。向Na2SO3溶液中加入盐酸酸化的NaClO溶液时,证明NaClO不足时的试剂是________。
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka大于其水解平衡常数Kh。______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列生物材料:①苹果②黄豆种子③梨④花生种子⑤蛋清⑥马铃薯块茎。最适于用来鉴定还原性糖的有 ( )
A. ①③⑥ B. ①②③ C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)检查装置 A 的气密性方法是:_____。
(2)装置 B 中饱和食盐水的作用是_____;同时装置 B 亦是安全瓶,监测实验进行时 C中是否发生堵塞,请写出发生堵塞时 B 中的现象_____。
(3)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入_____。
A | B | C | D | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置 D、E 的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置 D 中少量溶液加入装置 E 中,振荡,观察到的现象是_____,该现 象_____(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )

A.上下移动①中铜丝可控制SO2的产生与停止
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认有CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com