
【题目】在-50℃时液氨中存在着下列平衡:2NH3(液)![]() NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
A. 离子积为1.0×10-15
B. 离子积为1.0×10-30
C. 向液氨中加入氨基钠(NaNH2),液氨的离子积增大
D. 向液氨中加入NH4Cl,c(NH4+)增大,离子积的数值也随之增大
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案,其中t3 <t2 <t1:
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | |||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 | t1 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 | t2 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | t3 |
请回答:
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。当观察到紫色刚好褪去,参加反应的H2C2O4和KMnO4的物质的量之比为n(H2C2O4)∶n(KMnO4)=_________。
(2)实验①测得KMnO4溶液的褪色时间为t1=40s,忽略混合前后溶液体积的变化,这段时间内平均反应速率υ(KMnO4)=___________mol/(L·min)。
(3)根据表中的实验②和实验③数据,可以得到的结论是__________________________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图a所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应当如图b所示:

该小组同学根据图b所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是__________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 向试管中加入少量固体 | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||||
④ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | _____ | t4 |
③若该小组同学提出的假设成立,应观察到的现象是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
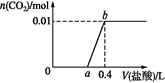
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法不正确的是

A. 放电时,负极反应式:Li-e- =Li+
B. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗标准状况下11.2 L O2
C. 放电时,随外电路中电子的转移,水性电解液中离子总数减少
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液,滴定曲线如图。下列说法不正确的是
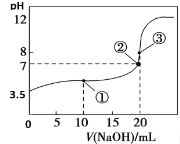
A. 常温下,HA电离常数为1.0×10-6
B. 点②所示溶液中:c(Na+)< c(HA)+c(A-)
C. 点③所示溶液中:c(Na+)> c(A-)> c(OH-)>c(H+)
D. 从点①到点③的滴定过程中,水的电离程度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸的体积有如图所示的关系(不考虑CO2在水中的溶解)。下列说法不正确的是( )
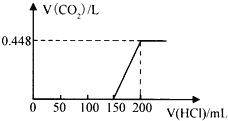
A. 滴加盐酸0→150mL段发生的反应依次为OH-+H+=H2O、CO32-+H+=HCO3-
B. 所用盐酸的物质的量浓度为0.4 molL﹣1
C. CO2体积不再改变时,溶液中的溶质为NaCl
D. 该样品中NaOH与Na2CO3物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,常用Fe2(SO4)3溶液作腐蚀液,腐蚀铜质电路板得到废液主要成分是FeSO4和CuSO4,含少量Fe2(SO4)3。某学习小组设计装置从废液中提取铜,如图所示。已知:Fe2+失电子能力比OH- 强。下列说法正确的是

A. 电解初期阴极没有铜析出,原因是2H++2e-=H2↑
B. 石墨极的电极反应式为2H2O+4e-=4H++O2↑
C. 若电路中转移2mol电子,理论上有2molM从交换膜左侧向右侧迁移
D. 若将废液2充入阳极室时可再生腐蚀液(硫酸铁溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com