
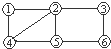
 如图所示,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应.供选择的物质有:a.铁;b.稀H2SO4;c.Na2CO3溶液;d.BaCl2溶液;e.Cu(NO3)2溶液;f.MgSO4溶液.图中编号④代表的物质是
如图所示,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应.供选择的物质有:a.铁;b.稀H2SO4;c.Na2CO3溶液;d.BaCl2溶液;e.Cu(NO3)2溶液;f.MgSO4溶液.图中编号④代表的物质是

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:黑龙江省牡丹江一中2010-2011学年高二下学期期末考试化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都高新区高三9月统一检测化学试卷(解析版) 题型:填空题
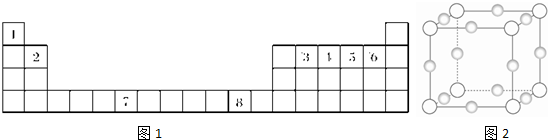
(13分) 下表为元素周期表的一部分,其中编号代表对应的元素。

请回答下列问题:
(1)写出元素⑦的基态原子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的轨道表示式为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素④和⑥的第一电离能大小顺序是 > (用元素符号表示)。请写出由④和⑤两种元素形成的与N3-互为等电子体的离子的化学式 ,其VSEPR构型为 。
(4)在测定①和⑥形成的化合物的相对分子质量时,实验测得值一般高于理论值,其主要原因是 。
(5)④和⑧形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中④显-3价),则其化学式为 。

⑧的常见离子和④的最简单氢化物形成的配离子的名称为 ,
其水溶液颜色为 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
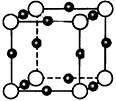
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com