
| A. | 反应Mg+2HCl→MgCl2+H2↑+Q(Q>0)分别在20℃和50℃进行 | |
| B. | 颗粒大小同的铁和镁分别与0.1mol/L的硫酸反应 | |
| C. | 同浓度同体积的Na2S2O3溶液分别与同体积的0.1mol/L、0.2mol/L的稀硫酸反应 | |
| D. | 其他条件相同时,硫分别在氧气和空气中燃烧 |
分析 A、依据化学反应速率影响因素分析,温度升高反应速率增大;
B、颗粒大小同的铁和镁与同浓度酸反应,活泼的金属反应快;
C、溶液浓度越大反应速率越快;
D、物质浓度越大反应速率越快;
解答 解:A、依据化学反应速率影响因素分析,温度升高反应速率增大,前者小于后者,故A错误;
B、颗粒大小同的铁和镁与同浓度酸反应,活泼的金属镁反应快,前者小于后者,故B错误;
C、溶液浓度越大反应速率越快,同浓度同体积的Na2S2O3溶液分别与同体积的0.1mol/L、0.2mol/L的稀硫酸反应,前者小于后者,故C错误;
D、物质浓度越大反应速率越快,其他条件相同时,硫分别在氧气和空气中燃烧,前者一定大于后者的反应速率,故D正确;
故选D.
点评 本题考查了影响化学反应速率的因素分析判断,注意增大浓度、升高温度、增大压强是外因影响,物质本性是内因,题目较简单.


科目:高中化学 来源: 题型:填空题
 能源是现代社会发展的支柱之一,化学能是重要的能源.
能源是现代社会发展的支柱之一,化学能是重要的能源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 Z>Y>X | |
| B. | Z的非金属性最强 | |
| C. | 氢化物还原性XH3>H2Y>HZ,稳定性XH3>H2Y>HZ | |
| D. | 最高氧化物对应水化物H3XO4酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡后静置,下层液体未褪色 | |
| C. | 1mol苯能与3mol H2发生加成反应,说明在苯环中含有3个双键 | |
| D. | 用冰冷却苯,苯可以凝结成无色的晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
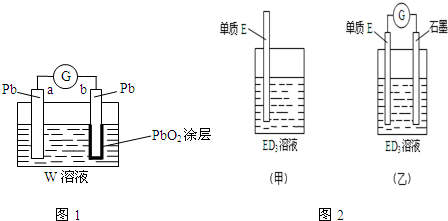
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com