
����Ŀ���������ѧ֪ʶ���ش��������⣺
ijѧϰС��������ͼ��ʾװ��A��B�ֱ�̽������п��ϡ����ķ�Ӧ��ʵ�������A�ձ��ڵ���Һ�¶����ߣ�B�ձ��ĵ�����ָ�뷢��ƫת����ش��������⡣
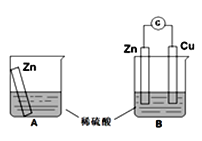
(1)B��Zn����_________���������ĵ缫��Ӧ��_________________��Cu���ϵ�������___________��
(2)������ת���ĽǶ������� A���ǽ���ѧ��ת��Ϊ_________��B����Ҫ�ǽ���ѧ��ת��Ϊ_________��
(3)��С��ͬѧ��˼ԭ��ص�ԭ�������й۵���ȷ����_________��
A��ԭ��ط�Ӧ�Ĺ�����һ���е���ת��
B���缫һ�����ܲμӷ�Ӧ
C��ԭ���װ���еĵ���������������·�������������������
D��������Ӧ�ͻ�ԭ��Ӧ���Բ�����������
(4)��B�У�����������1mol����ͨ��ʱ�������ϵ������仯��_________��
A��пƬ�ܽ�32.5g B��пƬ����32.5g
C��ͭƬ������2gH2 D��ͭƬ������1mol H2
���𰸡��� Zn-2e-�TZn2+ ����ɫ������� ���� ���� AD A
��������
(1)п-ͭ-ϡ����ԭ����У����ý���п��������пʧ���ӷ���������Ӧ��������������ͭ�ϵõ��ӷ�����ԭ��Ӧ��
(2)A�ձ����¶����ߣ��÷�Ӧ�Ƿ��ȷ�Ӧ��ԭ��ؽ���ѧ��ת���ɵ��ܣ�
(3)����ԭ���ԭ�������жϣ�
(4)п-ͭ-ϡ������ɵ�ԭ��ط�ӦΪZn+H2SO4=ZnSO4+H2 ��������ת�Ƶĵ��ӽ����ڷ���ʽ�������㡣
(1)п-ͭ-ϡ����ԭ����У����ý���п���������缫��ӦΪZn-2e-�TZn2+��������������ͭ�ϵõ��Ӳ�������������Cu���ϵ�����������ɫ����������ʴ�Ϊ������Zn-2e-�TZn2+������ɫ���������
(2)ʵ�������A�ձ����¶����ߣ�˵���÷�Ӧ�Ƿ��ȷ�Ӧ�����Է�Ӧ����������������������������Ӧ�н���ѧ��ת�������ܣ�ԭ����ǽ���ѧ��ת���ɵ��ܣ��ʴ�Ϊ�����ܣ����ܣ�
(3)A��ԭ���Ҫ���Է����е�������ԭ��Ӧ������һ���е��ӵ�ת�ƣ���A��ȷ��B�����ý�����������������������ʧ���ӷ���������Ӧ�������ϵõ��ӷ�����ԭ��Ӧ��һ�㸺���ܽ⣬�����������ػ��������壬��B����C�����Ӳ���ͨ���������Һ����C����D����������������Ӧ������������ԭ��Ӧ��ԭ��ؽ�������Ӧ�ͻ�ԭ��Ӧ���Բ���������������D��ȷ���ʴ�Ϊ��AD��
(4)��ԭ��طŵ�ʱ��������пʧ���ӷ���������Ӧ�������������ӵõ��ӷ�����ԭ��Ӧ�����Ե�ط�ӦΪZn+H2SO4=ZnSO4+H2 ����
�赱��������1mol����ͨ��ʱ�������ϸ���пƬ�ܽ�x��ͭƬ����������y��
Zn+H2SO4=ZnSO4+H2 �� ת�Ƶ���
65g 1mol 2mol
x y 1mol
��![]() =
=![]() =
=![]() ����ã�x=32.5g��y=0.5mol��
����ã�x=32.5g��y=0.5mol��
��п�ܽ���32.5g�����������أ���A��ȷ��B����
ͭƬ��������0.5mol����������Ϊ1g����C��D����
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ͳ�Ļ������������Ĺ屦���Ŵ������м����˴����Ŵ���ѧ���о��ɹ����ش�����������
��1���ҹ���ԭʼ���մ�Լ�����ھ��12000��ǰ�������������õ�ԭ���Ǹ���ʿ���侧�廯ѧʽ��Al4[Si4O10](OH)8�����������ʾ�����Ϊ______________��
��2�������ݸ�Ŀ���м��أ�������ҩ��������( KNO3)����ǡ�ɼľ̿���ϣ���Ϊ����糧���ҩ�ߡ�����Ӧԭ��Ϊ��S+2KNO3+3C![]() K2S+N2��+3CO2�����÷�Ӧ����������____ ����Ӧת��4mol����ʱ����S������C��____mol��
K2S+N2��+3CO2�����÷�Ӧ����������____ ����Ӧת��4mol����ʱ����S������C��____mol��
��3���ҹ��Ŵ���ҩѧ���������ޱ��ݡ����ص�ҩ����844�֣������й����෯��������Ϊ����������ɫ���³���δ�����ߣ������������֮��ɫ�������ҹ����ڿƼ����顶����С��-��ʯ�ࡷ �����м����෯ʱ�ľ������෯����Ѭ�ˣ��·���֮���ã���ľ��ʢ�����෯�����̷�( FeSO4��7H2O)������������Ϣ��д�����෯�����ȷֽ�Ļ�ѧ����ʽ_________________��
�����ǻ������������ֺ������绢���������������ִ���ҵ��ζ����������ϡ�����ȶ��ģ������������ܽ���Ũ����������VO2+��
��4����д����������Ũ���ᷴӦ�����ӷ���ʽ��_______________________________��
��5��V2O5�������������ǿ�Ӧ���ɷ�����(������ΪVO43-)������ǿ�����ɺ���������(VO2+)���Ρ���д��V2O5�ֱ����ռ���Һ��ϡ���ᷴӦ���ɵ��εĻ�ѧʽ��_____________�� _____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:N2O4(g)![]() 2NO2(g)����װ��N2O4��NO2����������ƿ������ˮ�У���ƿ�ڻ���������ɫ������н��۲���˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
2NO2(g)����װ��N2O4��NO2����������ƿ������ˮ�У���ƿ�ڻ���������ɫ������н��۲���˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
A. ��ƿ��������������ٱ仯
B. ��ƿ���������ɫ���ٱ仯
C. ��ƿ�������ѹǿ���ٱ仯
D. N2O4������������NO2����������֮��Ϊ1:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǰ��ԴΣ����һ��ȫ�������⣬��Դ������Ӧ����ԴΣ������Ҫ�ٴ롣
��1������������������Դ����Դ����������________(����ĸ)��
A��������չũ���������������Ľո�ת��Ϊ����Ч����Դ
B����������ú��ʯ�ͺ���Ȼ������������������������Դ����
C������̫���ܡ�ˮ�ܡ����ܡ������ܵ�����Դ������ʹ��ú��ʯ�͵Ȼ�ʯȼ��
D��������Դ���ģ��Ӵ���Դ���ظ�ʹ�á���Դ��ѭ������
��2�����ʯ��ʯī��Ϊ̼��ͬ�������壬��������������ʱȼ������һ����̼������������ʱ���ȼ�����ɶ�����̼����Ӧ�зų���������ͼ��ʾ������ͨ��״���£����ʯ��ʯī��Ƚϣ�________(����ʯ����ʯī��)���ȶ���ʯī��ȼ���Ȧ�H��________��

��3����֪��N2��O2�����л�ѧ���ļ��ֱܷ���946 kJ/mol��497kJ/mol��N2(g)��O2(g)=2NO(g)����H����180kJ/mol��NO�����л�ѧ���ļ���Ϊ__________________kJ/mol��
��4���ۺ������й���Ϣ����д����CO��ȥNO��������Ⱦ������Ȼ�ѧ����ʽ��________________��
��5����֪Na2SO4��10H2O![]() Na2SO4��nH2O��(10��n)H2O����װ��â��(Na2SO4��10H2O)���ܱվ���ϩ�ܰ�װ�ڷ��ݵ���ǽ�ھ��ܴﵽ�������ȣ�ʹ���ڱ��ֽϵ��¶ȣ����ϰѰ�������������ų���ʹ���ڱ�����ů��Ŀ�ġ����������ϵ�����ת����ʽ�ǰ��콫________��ת��Ϊ________�ܣ����Ͻ�________��ת��Ϊ________�ܡ�
Na2SO4��nH2O��(10��n)H2O����װ��â��(Na2SO4��10H2O)���ܱվ���ϩ�ܰ�װ�ڷ��ݵ���ǽ�ھ��ܴﵽ�������ȣ�ʹ���ڱ��ֽϵ��¶ȣ����ϰѰ�������������ų���ʹ���ڱ�����ů��Ŀ�ġ����������ϵ�����ת����ʽ�ǰ��콫________��ת��Ϊ________�ܣ����Ͻ�________��ת��Ϊ________�ܡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��X�Ƕ�������ԭ�Ӱ뾶��С��Ԫ����X��Y��ɵ��������ʹʪ��ĺ�ɫʯ����ֽ������
��Y��ԭ�ӽṹʾ��ͼ��______________,�Ŀռ乹��Ϊ__________��
��д������������Һ��ͨ���������ķ�Ӧ�����ӷ���ʽ_________________��
��2������������Һ�������ɢ�����Ʊ����������������һ�ֹ����������¡�
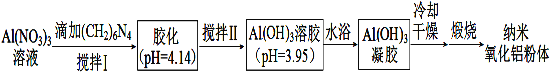
��֪����(CH2)6N4ˮ��Һ�Լ��ԡ�
��Ksp[Al(OH)3] =1.3��10��33 ����Һ������Ũ��С��1��10��5 mol��L��1ʱ������Ϊ������������Һ�в����ڡ�
�����к��е������γ����������___________________�����������ƣ���
��3�����⾧��(quasicrystal)��һ�־���������������ε���ͬ�ھ���Ĺ�̬���ʡ�ij�������⾧�� �Ļ�ѧʽΪ:Al65Cu23Fe12, ���Ƕ�ʮ���ͷ��ֵļ������⾧֮һ�����кϽ��ijЩ�����������ܡ������й������⾧��˵����ȷ����_______________��(����)
A����ȷ��Al65Cu23Fe12�����ֽ����Ļ��ϼ�
B��Al65Cu23Fe12��Ӳ��С�ڽ�����
C��Al65Cu23Fe12�����������ڽ����ں�ˮ�еIJ���
D��1 mol Al65Cu23Fe12���ڹ���������ʱ��ʧȥ265 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��A��B��C��D��E��ԭ��������������A��Cͬ�壬B��Dͬ�壬C���Ӻ�B���Ӿ�����ͬ�ĵ��Ӳ�ṹ��A��B��D��E�����γɹ����ͻ����A��B�γɵĻ�������ˮ�гʼ��ԣ�C��E�γ����ӻ�������������Ӹ�����Ϊ1��1���ش��������⣺
��1������Ԫ���зǽ�������ǿ����_______________����Ԫ�ط��ţ���
��2����A��B��D��E���γɵĹ��ۻ������У����ȶ���������___________���û�ѧʽ��ʾ����
��3��C��E�γɵ����ӻ�����ĵ���ʽΪ ______ ���õ���ʽ��ʾA��B�γɵĹ���_____��A��E�γɵĻ�������A��B�γɵĻ����ﷴӦ������Ļ�ѧʽΪ_______________
��4��D������������ˮ����Ļ�ѧʽΪ____________________��
��5����A��B�γɵ�һ�������ڹ�ҵ����;�ܹ㣬ʵ������ȡ�ķ���ʽΪ____________________��
��6������E��ˮ��Ӧ�����ӷ���ʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ⱥ��ʳ��ˮ���ȼҵ������
(1)д����ⱥ���Ȼ�����Һʱ���ܵ����ӷ�Ӧ����ʽ��________________________________________��
(2)����������1molH2ʱ��ͨ�������ӽ���Ĥ��Na+��_________mol��
(3)������������������TiCl4����TiO2��Cl2����ֱ�ӷ�Ӧ����̼����CO��CO2��ʹ��Ӧ���Խ��С��ش�
��֪��TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) ��H1=+175.4kJmol��1
2C(s) + O2(g)=2CO(g) ��H2=��220.9kJmol��1
��TiO2��Cl2����ֱ�ӷ�Ӧ��ԭ����__________________________________________
�ڼ�̼����CO��CO2����Խ���ԭ����________________________________________________________
(4)�ȼҵ�Ǹߺ��ܲ�ҵ��һ�ֽ�������ȼ�ϵ������ϵ��¹��տ��Խ�(��)��30%���ϡ������ֹ�������У�������ϵĴ�����ת����ϵ��ͼ��ʾ�����еĵ缫δ��������õ�����Ĥ��ֻ����������ͨ����
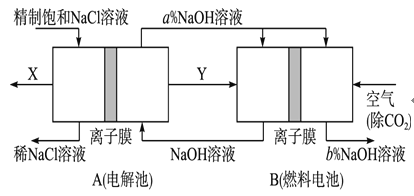
��ͼ��Y��________ (�ѧʽ)��
��д��ȼ�ϵ��B�и����Ϸ����ĵ缫��Ӧ��______________________________________________
�۱Ƚ�ͼʾ������������Һ���������Ĵ�С��a%_______b%���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״���£�4.48 L��ˮ(D2O)�к��е�������Ϊ2NA
B. ��ҵ����Cl2��ʯ���鷴Ӧ��ȡƯ�ۣ�ÿ��Ӧ1molCl2��ת�Ƶ�����ΪNA
C. ��1 mol��������ϩ�Ļ�������У���ԭ����Ϊ5NA
D. 0.3mol��L��1��CuSO4��Һ�к���SO![]() ����ĿΪ0.3NA
����ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϣʹ��һ�������Ľ�����ʹ������ṹ��ʽΪ �����¶����������д������(����)
�����¶����������д������(����)
A. �����ռ���Һ��Ӧ
B. ����Ũ��ˮ����ȡ����Ӧ
C. �ܷ���ˮ�ⷴӦ
D. �ܷ����Ӿ۷�Ӧ�γɸ߷��ӻ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com