
| A. | 钱恩 | B. | 屠呦呦 | C. | 弗莱明 | D. | 莫言 |
科目:高中化学 来源: 题型:解答题
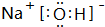 .
.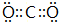 .属非极性分子(填分子极性).EC2其固体属原子晶体.
.属非极性分子(填分子极性).EC2其固体属原子晶体.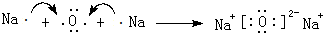 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂质应选用的试剂和操作方法 | |
| A | CO2 | CO | 通入O2,点燃 |
| B | 乙醇 | 汽油 | 加入CCl4萃取、分液 |
| C | Cu(NO3)2溶液 | AgNO3溶液 | 加入过量的铜粉,过滤 |
| D | KNO3溶液 | KOH溶液 | 加入适量的CuSO4溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 铁在潮湿的空气中容易腐蚀 | |
| C. | 镀锌的铁制品比镀锡的铁制品耐用 | |
| D. | 常温下铝跟稀硫酸快速反应,跟浓硫酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CH4的电极为正极 | |
| B. | 放电时溶液中的阳离子向负极移动 | |
| C. | 负极的电极反应式为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 通入CH4的电极反应式为:CH4+2O2+4e-═CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
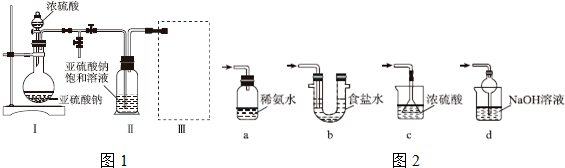

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
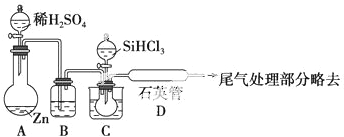
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com