
用0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )

A.22.30 mL B.22.35 mL C.23.65 mL D.23.70 mL
科目:高中化学 来源:2014年化学高考总复习课时演练 2-2离子反应练习卷(解析版) 题型:选择题
实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为1 mol/L。下面四个选项中能达到此目的的是( )
A.Na+、K+、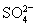 、Cl- B.Cu2+、K+、
、Cl- B.Cu2+、K+、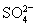 、
、
C.H+、K+、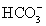 、Cl- D.Mg2+、Na+、Cl-、
、Cl- D.Mg2+、Na+、Cl-、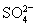
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 11-3物质的制备练习卷(解析版) 题型:选择题
有下列两种转化途径,某些反应条件和产物已省略,下列有关说法不正确的是( )
途径① S H2SO4
H2SO4
途径② 
A.途径①反应中体现了浓硝酸的强氧化性和酸性
B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本
C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 11-1化学实验仪器和基本操作练习卷(解析版) 题型:实验题
某研究小组甲欲用KMnO4测定FeSO4的含量。
(1)①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液200 mL,配制时需要的仪器除天平、药匙外,还需要的仪器有_____、_____、_____、_____、_____。
②用KMnO4(酸化)滴定时,含硫酸亚铁的溶液放在_____(填仪器)中,高锰酸钾溶液放在______(填仪器)中,滴定终点时溶液的颜色为_____色。
(2)另一研究小组乙设计了如下测量方案:

①过滤时用到的玻璃仪器有________________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有_____(按操作的顺序填写)。
A过滤;B洗涤;C萃取;D分液;E冷却;F灼烧
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 1-2物质的量在实验中的应用练习卷(解析版) 题型:选择题
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为w,其中含 的物质的量为b mol。下列叙述中正确的是( )
的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w= ×100%
×100%
B.溶质的物质的量浓度c= mol/L
mol/L
C.溶液中c(OH-)= mol/L
mol/L
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 1-2物质的量在实验中的应用练习卷(解析版) 题型:选择题
有硫酸镁溶液500 mL,它的密度是1.20 g/cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是( )
A.溶质的质量分数是24.0%
B.溶液的物质的量浓度是2.4 mol/L
C.溶质和溶剂的物质的量之比是1∶40
D.硫酸根离子的质量分数是19.2%
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第四章非金属及其化合物练习卷(解析版) 题型:实验题
某研究性学习小组欲利用已经学过的化学知识和下列装置制取少量次氯酸钠,并进一步探究次氯酸钠的化学性质。


相关资料:反应Cl2+2NaOH=NaClO+NaCl+H2O属于放热反应,温度稍高时便发生副反应:3Cl2+6NaOH=NaClO3+5NaCl+3H2O。
(1)制取氯气时,在烧瓶中加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。请在装置A、B、C中选择一个合适的装置放在②处________。
(2)部分学生认为上述装置存在缺点,他们指出在前两个仪器之间应增加如D图所示的装置:你认为D中所盛液体是________,其作用是____________。

(3)该化学兴趣小组对产品的性质进行了如下探究。
第一步,测其pH=10。结合相关离子方程式解释原因________。
第二步,该化学兴趣小组的同学备选了紫色石蕊试液对次氯酸钠的性质进行实验检验。请你帮助他们完成实验报告:
实验操作 | 预期现象 | 结论 |
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第六、七章化学反应与能量速率平衡卷(解析版) 题型:填空题
将水煤气转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域。除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为 。
②下列能增大碳的转化率的措施是 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4(g)+3/2O2(g)  CO(g)+2H2O(g) ΔH=-519 kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO(g)+2H2O(g) ΔH=-519 kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”、“Y”或“Z”),选择的理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com