
氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g)+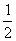 O2(g)====H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)====H2O(l) ΔH=-285.8 kJ·mol-1
CO(g)+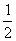 O2(g) ====CO2(g) ΔH=-283.0 kJ·mol-1
O2(g) ====CO2(g) ΔH=-283.0 kJ·mol-1
C8H18(l)+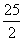 O2(g) ====8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
O2(g) ====8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
CH4(g)+2O2(g) ====CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示。下列描述正确的是( )
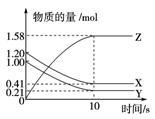
A、反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1
B、反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C、反应开始到10 s时,Y的转化率为79.0 %
D、反应的化学方程式为:X(g)+Y(g)  Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
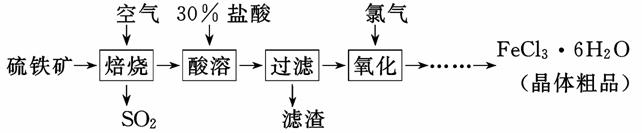
回答下列问题:
Ⅰ、(1)在一定条件下,SO2转化为SO3的化学反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
Ⅱ、 已知: CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如图所示:
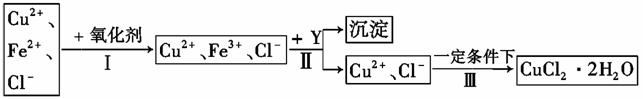
请回答下列问题:
(4)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的 (填字母)。
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为 。
(5)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的 (填字母)。
A.NaOH B.Cu C.Cu2(OH)2CO3
(6)步骤Ⅲ应控制的实验条件是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
浓H2SO4 密度1.84g/mL,物质的量浓度为18.4 mol/L , 质量分数为98% ,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%。下列组合正确的是
(1). 若b=49 则a=18.4 C>9.2 (2) 若b=49 则a=18.4 C<9.2
(3). 若C=9.2 则a>10 b>49% (4) 若C=9.2 则a>10 b<49%
A.(1) (3) B.(1) (4) C.(2) (3) D.(2) (4)
查看答案和解析>>
科目:高中化学 来源: 题型:
沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2和液态H2O时,放出445 kJ的热量,则下列热化学方程式正确的是( )
A.2CH4(g)+4O2(g)====2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1
B.CH4(g)+2O2(g) ====CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
C.CH4(g)+2O2(g) ====CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
D.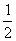 CH4(g)+2O2(g)====
CH4(g)+2O2(g)====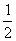 CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1
B.C2H2(g)+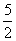 O2(g)====2CO2(g)+H2O(l) ΔH=2b kJ·mol-1
O2(g)====2CO2(g)+H2O(l) ΔH=2b kJ·mol-1
C.2C2H2(g)+5O2(g) ====4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1
D.2C2H2(g)+5O2(g) ====4CO2(g)+2H2O(l) ΔH=b kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
钛和钛的合金被誉为21世纪最有发展前景的金属材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、耐腐蚀等,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切合实际的是
A.用来做保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于家庭装修,做钛合金装饰门
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为:
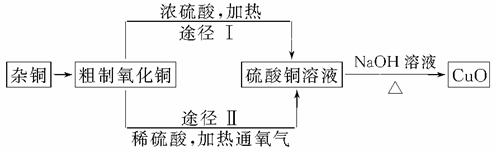
(1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是________。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c. 氧化铜在加热过程中分解生成铜
氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是_______________________________________________________________________。
(3)有同学指出,由CuSO4溶液到生成CuO少了一个环节,即应先生成Cu(OH)2沉淀,过滤洗涤后再加热分解Cu(OH)2得CuO。以下说法不可能成为减少该环节的理由的是________。
A.CuO比Cu(OH)2颗粒粗大,更易于过滤从溶液中分离
B.Cu(OH)2 分解温度较低,加热其浊液即可使其分解
分解温度较低,加热其浊液即可使其分解
C.干态下分解Cu(OH)2,温度难以控制,可能因温度过高导致CuO进一步分解生成Cu2O
D.过滤分离出的CuO不需洗涤就已非常纯净
查看答案和解析>>
科目:高中化学 来源: 题型:
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:

填写下列空白:
(1)甲中不含氧原子的官能团是________;下列试剂能与甲反应而褪色的是________(填标号)
a.Br2/CCl4溶液 b.石蕊溶液
c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:________。
(3)淀粉通过下列转化可以得到乙(其中A~D均为有机物):
淀粉 A
A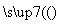 B
B C
C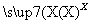 D
D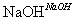 乙
乙
A的分子式是________,试剂X可以是________。
(4)已知:

利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是________________________________________________________
________________________________________________________________________。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶 液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为________。
液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com