
【题目】多巴胺的一种合成路线如下图所示
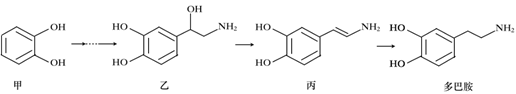
下列说法正确的是
A. 原料甲与苯酚互为同系物 B. 中间产物乙、丙和多巴胺都具有两性
C. 多巴胺不可能存在氨基酸类的同分异构体 D. 1mol 甲最多可以和2 mol Br2发生取代反应
科目:高中化学 来源: 题型:
【题目】石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H1=-362 kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为__________________。
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为_______。(已知H2CO3 的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(3)在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS 的脱硫。该反应的化学方程式为_______。
(4)COS的水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
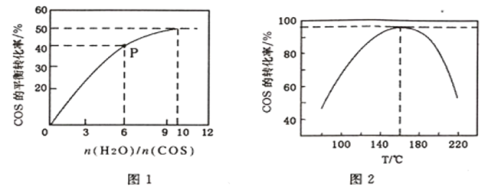
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]__________,温度__________。
②P点对应的平衡常数为_____________ 。(保留小数点后2 位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示

下列说法正确的悬
A. △H1<0,△H2>0
B. 反应①②③的反应热满足关系:△H2-△H1=△H3
C. 反应①②③的平衡常数满足关系;K1·K2=K3
D. 要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼[(CH3)2N—NH2]与N2O4是常用的火箭推进剂,火箭发射时常出现红棕色气体,发生的化学反应如下:
① (CH3)2N—NH2(l) + 2N2O4(l) = 2CO2(g) + 3N2(g) + 4H2O(g) H1<0
② N2O4(l) ![]() 2NO2(g) H2 >0
2NO2(g) H2 >0
下列说法不正确的是
A.反应①中,N2O4为氧化剂
B.反应①中,生成1mol CO2时,转移8 mol e-
C.由反应②推断:加压、降温是获得液态N2O4的条件
D.温度升高,反应①的化学反应速率减小、反应②的化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行二氧化硫制备与性质实验的组合装置(如图),部分固定装置未画出。
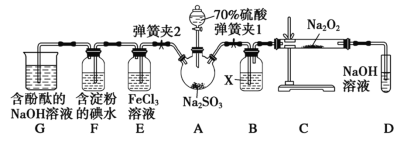
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是___,再往D中装水,然后微热A,观察到D中有气泡冒出,移开酒精灯,D中导气管中有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置B中试剂X是___,它的作用是___。
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是___。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为___,发生反应的离子方程式是___。
(5)E中溶液由棕黄色变为浅绿色,写出发生反应的离子方程式。___
(6)G中含酚酞的NaOH溶液逐渐褪色,欲证明褪色的原因是SO2具有漂白性还是SO2溶于水显酸性。请设计实验___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是
![]()
A.甲一定是金属元素
B.气态氢化物的稳定性:庚>己>戊
C.乙、丙、丁的最高价氧化物的水化物可以相互反应
D.庚的最高价氧化物的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q五种短周期主族元素的原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3∶8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一。请回答下列问题:
(1)Q元素在周期表中的位置是_______________________________________。
(2)这五种元素的原子半径从大到小的顺序为__________________(填元素符号)。
(3)元素的非金属性:Z________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有________(填字母)。
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与它的+4价氧化物反应的化学方程式为________________________。
(5)X与Y可形成分子A,也可形成阳离子B,A与B都是10电子构型,写出阳离子B的电子式:__________,如何检验溶液中阳离子B的存在,请说出简要的实验方法:______,A的空间构型是______;实验室制备气体A的化学方程式:_______________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g) + 4H2(g)![]() CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
A. 该反应的ΔH < 0 B. 化学平衡常数K增大
C. CO2的转化率增加 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com