
在恒容密闭容器中通入X并发生反应:2X(g)  Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )

A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=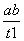 mol·L-1·min-1
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
科目:高中化学 来源: 题型:
下列反应中,改变反应物的用量或浓度,不会改变生成物的是( )
A.铜和硝酸反应
B.二氧化碳通入氢氧化钠溶液中
C.细铁丝在氯气中燃烧
D.氯化铝与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将BaO2放入密闭的真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A.平衡常数减小 B.BaO量不变
C.氧气压强不变 D.BaO2量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,N2O分解的部分实验数据如下:
| 反应时间 /min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O) (mol·L-1) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间 /min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O) (mol·L-1) | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
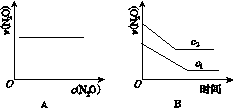
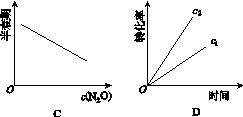
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为____________________________________________。
(2)反应AX3(g)+X2(g)  AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=______________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为____________(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b________________________________________________,c____________________________________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为______________;实验a和c的平衡转化率:αa为________,αc为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,N2O分解的部分实验数据如下:
| 反应时间 /min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O) (mol·L-1) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间 /min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O) (mol·L-1) | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
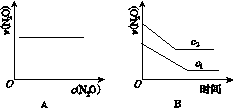
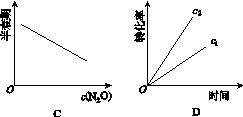
查看答案和解析>>
科目:高中化学 来源: 题型:
是一种高能燃料,有关化学反应的能量变化如题12所示,已知断裂1mol化学键所需的能量(kJ):N=N为942、O=O为500、N−N为154,则断裂1molN−H键所需的能量(KJ)是


A.194 B.391 C.516 D.658
查看答案和解析>>
科目:高中化学 来源: 题型:
2014年3月11某高速公路萧山路段一辆运送化学物品的槽罐车侧翻,罐内15 t苯泄漏
入路边300 m长的水渠,造成严重危险,许多新闻媒体进行了报道,以下报道中有科学性错误的是( )
A.由于大量苯溶入水中渗入土壤,会对周边农田、水源造成严重污染
B.由于苯是一种易挥发、易燃的物质,周围地区如果有一个火星就可能引起爆炸
C.可以采取抽吸水渠中上层液体的办法,达到部分清除泄漏物的目的
D.处理事故时,由于事故发生地周围比较空旷,有人提出用点火焚烧的办法来清除泄漏物,但由于苯燃烧会产生大量的黑烟扩大污染,所以该办法未被采纳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com