
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④ 混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
【答案】B
【解析】试题分析::①该反应是反应前后气体体积没有变化的反应,所以容器中的压强不再发生变化,不能证明达到了平衡状态,故①错误;②该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量不变,所以容器内气体的密度不变,当容器中气体的密度不再发生变化时,不能表明达到化学平衡状态,故②不正确;③反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量浓度等不再发生变化,所以B的浓度不再变化时,该反应达到平衡状态,故③正确;④该反应是反应前后气体体积有变化的反应,所以气体总物质的量不变,能表明反应达到平衡状态,故④正确;⑤容器中的气体平均相对分子质量M=m/n,反应前后混合气体的质量不会变化,该反应是一个反应前后物质的量该变的反应,所以当M不再发生变化时,表明已经平衡,故⑤正确;⑥C、D反应速率的比值始终等于化学方程式的系数之比,故⑥错误;⑦总质量始终不变,故错⑧定容容器体积也始终不变,故错⑨生成C、D后,它们的分子数之比始终为1:1,故错


科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. C4H9Cl有3种同分异构体 B. 油脂和蛋白质都属于高分子化合物
C. 由乙烯生成乙醇属于加成反应 D. 2-甲基丁烷也称异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列对有关实验事实的解释正确的是
A.SO2气体使高锰酸钾溶液褪色,表现了SO2的漂白性
B.在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是Cu
C.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
D. 常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸发应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图及描述,回答下列问题: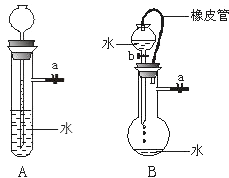
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示.试判断:A装置是否漏气?(填“漏气”、“不漏气”或“无法确定”) , 判断理由: .
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶.试判断:B装置是否漏气?(填“漏气”、“不漏气”或“无法确定”) , 判断理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色未知溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强.某学生还要鉴定此溶液中是否大量存在①Cu2+ ②Al3+ ③Cl﹣ ④NO3﹣ ⑤NH4+ ⑥CO32﹣⑦Na+ ⑧Mg2+ ⑨Fe3+,而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是
A. ③⑤⑥⑨ B. ①③⑥⑨ C. ③④⑦⑧⑨ D. ①②⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组成金属和溶液,能组成原电池的是
A. Cu、Cu、稀硫酸 B. Zn、Cu、稀硫酸
C. Cu、Zn、酒精 D. C、Cu、CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“钴酞菁(分子直径1.3×10–9m)”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似,我国科学家在世界上第一次为“钴酞菁”分子恢复了磁性。下列关于“钴酞菁”的说法正确的是
A.在水中形成的分散系属于悬浊液
B.在水中形成的分散系属于胶体
C.分子直径比Na+小
D.“钴酞菁”分子既能透过滤纸,也能透过半透膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3(Cl-和ClO-)的比值与反应的温度有关,用24gNaOH配成的250mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化):
(1)NaOH溶液的物质的量浓度_____mol·L-1;
(2)某温度下,反应后溶液中c(Cl-)=6c(ClO-),则溶液中c(ClO-) =_____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用480mL、0.5mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ=1.84g/cm3)的物质的量浓度为
(2)将下列步骤中的空格内所用仪器补充填写完整 ①用20mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到mL的容量瓶中
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复至室温
⑤向容量瓶中加入蒸馏水,在距离刻度1~2cm时,改用加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中.轻轻摇动容量瓶,使溶液混合均匀.
(3)实验中上述步骤的正确顺序为(填序号).
(4)填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”). ①所用的浓硫酸长时间放置在密封不好的容器中
②量取浓硫酸所用量筒有蒸馏水
③定容时,俯视液面
(5)取用任意体积的所配0.5mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是(填字母)
A.溶液中H2SO4的物质的量
B.溶液的浓度
C.溶液中SO42﹣的数目
D.溶液的密度
(6)在容量瓶上,下列标记不存在的是(填字母)
A.标线
B.温度
C.浓度
D.容量规格.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com