
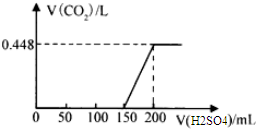
分析 (1)因为碳酸钠与硫酸反应生成碳酸氢钠,与碳酸氢钠与硫酸反应生成二氧化碳消耗硫酸的物质的量相等,所以由图可知V(硫酸l)在0~100mL区间内发生反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O;在100~150mL区间内发生反应的化学方程式为2Na2CO3+H2SO4=Na2SO4+2NaHCO3;
(2)由(1)知:硫酸滴加至150mL时,此时溶液中溶质主要成分为Na2SO4和NaHCO3;
(3)根据碳守恒可知:Na2CO3~CO2;
(4)加入150mL~200mL硫酸,发生反应:2NaHCO3+H2SO4═Na2SO4+2CO2↑+2H2O,根据生成二氧化碳计算n(H2SO4),再根据c=$\frac{n}{V}$计算;
(5)加入200mL硫酸时,生成0.448L二氧化碳,此时溶液中溶质为Na2SO4,由硫酸根离子守恒计算n(Na2SO4),根据碳元素守恒计算n(Na2CO3),根据钠离子守恒计算n(NaOH),据此解答.
解答 解:(1)因为碳酸钠与硫酸反应生成碳酸氢钠,与碳酸氢钠与硫酸反应生成二氧化碳消耗硫酸的物质的量相等,所以由图可知V(硫酸l)在0~100mL区间内发生反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O;在100~150mL区间内发生反应的化学方程式为2Na2CO3+H2SO4=Na2SO4+2NaHCO3,
故答案为:0-150mL间发生2NaOH+H2SO4=Na2SO4+2H2O、2Na2CO3+H2SO4=Na2SO4+2NaHCO3;
(2)由(1)知:硫酸滴加至150mL时,此时溶液中溶质主要成分为Na2SO4和NaHCO3,故答案为:Na2SO4和NaHCO3;
(3)根据碳守恒可知:Na2CO3~CO2,而二氧化碳的体积为0.448L,所以碳酸钠的物质的量为:$\frac{0.448L}{22.4L/mol}$=0.02mol,则质量为:0.02mol×106g/mol=2.12g,故答案为:2.12g;
(4)加入150mL~200mL硫酸,发生反应:2NaHCO3+H2SO4═Na2SO4+2CO2↑+2H2O,n(H2SO4)=$\frac{0.02}{2}$=0.01mol,则c=$\frac{n}{V}$=$\frac{0.01mol}{0.05L}$=0.2mol/L,故答案为:0.2mol/L;
(5)加入200mL硫酸时,生成0.448L二氧化碳,此时溶液中溶质为Na2SO4,
由硫酸根离子守恒计算n(Na2SO4)=0.2L×0.2mol/L=0.04mol,
根据碳元素守恒n(Na2CO3)=n(CO2)=0.02mol,
根据钠离子守恒n(NaOH)=2n(Na2SO4)-2n(Na2CO3)=0.08mol-0.02mol×2=0.04mol,
故该样品中NaOH与Na2CO3物质的量之比=0.04mol:0.02mol=2:1,
故答案为:2:1.
点评 本题以图象形式考查化学方程式计算,明确发生的反应是解题关键,注意(5)中利用守恒思想进行解答.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
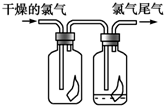 (1)如图所示,将氯气依次通过盛有干燥的有色布条和湿润的有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥的有色布条和湿润的有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+1s22s22p63s23p6 | B. | O2-1s22s22p4 | ||
| C. | Cl- 1s22s22p63s23p6 | D. | Ar1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
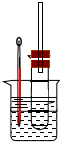 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含非极性键的分子一定是非极性分子 | |
| B. | 含有极性键的分子一定是极性分子 | |
| C. | 双原子极性分子一定含有极性键 | |
| D. | 非极性分子一定含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
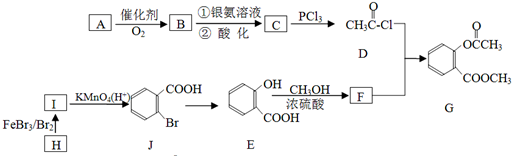
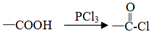
 ;
;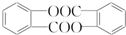 ;
;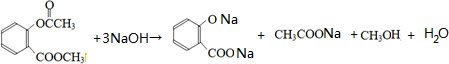 ;
;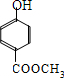 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氮气中含NA个氮原子 | |
| B. | 在标准状况下,1mol水的体积约为22.4L | |
| C. | 0.3 mol•L-1Na2SO4溶液中含0.6NA个Na+ | |
| D. | 18 g水中所含的氢原子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com