
| A. | 含非极性键的分子一定是非极性分子 | |
| B. | 含有极性键的分子一定是极性分子 | |
| C. | 双原子极性分子一定含有极性键 | |
| D. | 非极性分子一定含有非极性键 |
分析 同种非金属元素之间形成非极性键,不同种非金属元素之间形成极性键,结构对称,正负电荷的中心重合,则为非极性分子,否则为极性分子,据此分析.
解答 解:A.同种非金属元素之间形成非极性键,分子中正负电荷中心重合的为非极性分子,如H2O2,含有O-O非极性键,由于分子的正负电荷重心不重合,是极性分子,故A错误;
B.含有极性键的分子不一定是极性分子,如CO2是非极性分子,故B错误;
C.双原子极性分子一定含有极性键,如HCl是极性分子,含有极性键,故C正确;
D.非极性分子中可能只含极性键,如CH4,故D错误;
故选C.
点评 本题考查了键的极性与分子极性,题目难度不大,注意把握共价键的极性的判断和分子的极性的判断方法,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ③④⑤⑥ | C. | ②③⑤⑥ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度和减小压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 两种有机物的结构简式
两种有机物的结构简式 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 离子的氧化性aW3+>bX+ | D. | 原子序数:c>b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
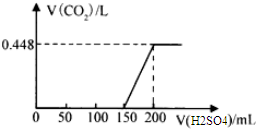
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40K和40Ca原子中的质子数和中子数都相等 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 几种核素具有相同的核电荷数,一定是同种原子 | |
| D. | 同种元素的不同核素之间互称同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第VⅡA族元素形成的氢化物中沸点最高的是HI | |
| B. | 第三周期元素形成的简单离子中,半径最小的是Al3+ | |
| C. | 用电子式表示HCl形成过程: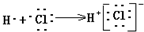 | |
| D. | 水分子很稳定性是因为水分子间易形成氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com