
分析:
A.离子反应中应遵循电荷守恒;
B.碱过量,过量的c(OH-)=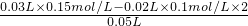 =0.01mol/L;
=0.01mol/L;
C.KAl(SO4)2、Ba(OH)2溶的物质的量之比为1:2,反应生成硫酸钡、偏铝酸钾、水;
D.电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒式为c(CH3COOH)+c(CH3COO-)=2c(Na+).
解答:
A.离子反应中应遵循电荷守恒,则镁与极稀硝酸反应生成硝酸铵的离子方程式为4Mg+10H++NO3-=4Mg2++NH4++3H2O,故A错误;
B.碱过量,过量的c(OH-)=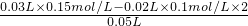 =0.01mol/L,所以混合溶液的pH为12,故B错误;
=0.01mol/L,所以混合溶液的pH为12,故B错误;
C.KAl(SO4)2、Ba(OH)2溶的物质的量之比为1:2,反应生成硫酸钡、偏铝酸钾、水,该反应中不生成氢氧化铝沉淀,故C错误;
D.电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒式为c(CH3COOH)+c(CH3COO-)=2c(Na+),所以c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故D正确;
故选D.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解本题的关键,注意计算反应物的物质的量的关系来判断生成物及溶液的酸碱性,题目难度中等.


科目:高中化学 来源: 题型:阅读理解

| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
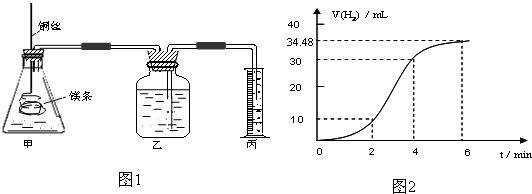
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com