
【题目】黄铜矿(CuFeS)是炼铜的最主要矿物,在野外很容易被误会为黄金,又称愚人金。
(1)火法冶炼黄铜矿的过程中,利用了Cu2O与Cu2S反应生成Cu单质,反应的化学方程式是___。
(2)S位于周期表中___族,该族元素氢化物中,H2Te比H2S沸点高的原因是__。H2O比H2Te沸点高的原因是__。
(3)S有+4和+6两种价态的氧化物,回答下列问题:
①下列关于气态SO3和SO2的说法中,正确的是__(填字母代号)。
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤电子对数目相等 D.都含有极性键
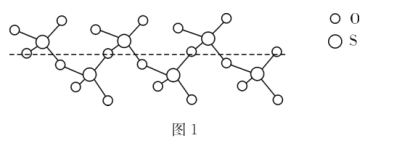
②将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图1,此固态SO3中S原子的杂化轨道类型是__。
(4)Cu有+1和+2两种价态的化合物,回答下列问题:
①Cu+的价电子排布图为___,Cu2+有__个未成对电子。
②新制的Cu(OH)2能够溶解于过量浓碱溶液中,反应的离子方程式是___。
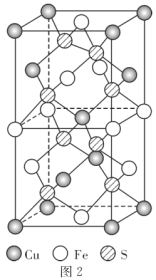
(5)CuFeS2的晶细胞如图2所示,晶胞参数α=0.524nm,c=1.032nm;CuFeS2的晶胞中每个Cu原子与__个S原子相连,列式计算晶体密度ρ=__g·cm-3。
【答案】2Cu2O+Cu2S![]() 6Cu+SO2↑ 第ⅥA 两者均为分子晶体且结构相似,H2Te相对分子质量比H2S大,分子间作用力更强 两者均为分子晶体,H2O分子间存在氢键 AD sp3
6Cu+SO2↑ 第ⅥA 两者均为分子晶体且结构相似,H2Te相对分子质量比H2S大,分子间作用力更强 两者均为分子晶体,H2O分子间存在氢键 AD sp3 ![]() 1 Cu(OH)2+2OH-=[Cu(OH)4]2- 4
1 Cu(OH)2+2OH-=[Cu(OH)4]2- 4 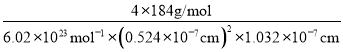 ≈4.31 gcm-3
≈4.31 gcm-3
【解析】
(1)Cu2O与Cu2S反应生成Cu单质,还生成二氧化硫;
(2)S的原子结构有3个电子层,最外层电子数为6,H2Te、H2S中相对分子质量大的沸点高,而水分子间存在氢键;
(3)①SO3中价电子对为3,没有孤对电子,为平面三角形;而SO2中价电子数为3,孤对电子数为1,为V型;
②图1中固态SO3中S原子形成4个共价单键;
(4)①Cu的原子序数为29,价电子为3d104s1,Cu2+中3d轨道上有9个电子;
②新制的Cu(OH)2能够溶解于过量浓碱溶液,生成络离子;
(5)由面心上Cu与2个S相连,晶胞中每个Cu原子与4个S相连;结合ρ=![]() 计算。
计算。
(1)Cu2O与Cu2S反应生成Cu单质,还生成二氧化硫,反应为2Cu2O+Cu2S![]() 6Cu+SO2↑;
6Cu+SO2↑;
(2)S的原子结构有3个电子层,最外层电子数为6,位于第ⅥA族,H2Te、H2S中相对分子质量大的沸点高,则H2Te沸点高,H2O比H2Te沸点高的原因是两者均为分子晶体,H2O分子间存在氢键;
(3)①SO3中中心原子硫价电子对为3,没有孤对电子,为平面三角形;而SO2中中心原子硫价电子数为3,孤对电子数为1,为V型,则
A.中心原子的价层电子对数目相等,故A正确;
B.三氧化硫是非极性分子,故B错误;
C.二者中心原子是硫,其孤对电子数目不等,故C错误;
D.都含有S与O之间的极性键,故D正确;
故答案为:AD;
②图1中固态SO3中S原子形成4个共价单键,S原子的杂化轨道类型是sp3;
(4)①Cu的原子序数为29,价电子为3d104s1,Cu+的价层电子排布式为3d10,电子排布图表示为![]() ,Cu2+中3d轨道上有9个电子,只有1个单电子;
,Cu2+中3d轨道上有9个电子,只有1个单电子;
②新制的Cu(OH)2能够溶解于过量浓碱溶液,生成络离子,反应的离子方程式是为Cu(OH)2+2OH-=[Cu(OH)4]2-;
(5)由面心上Cu与2个S相连,晶胞中每个Cu原子与4个S相连;8个S均在体内,由化学式为CuFeS2,则含晶胞质量为![]() ,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=
,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=![]() =
=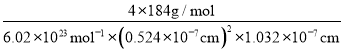 ≈4.31 gcm-3。
≈4.31 gcm-3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究![]() 、
、![]() 、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为:![]() 某研究小组向某密闭容器中加人一定量的活性炭和NO,恒温
某研究小组向某密闭容器中加人一定量的活性炭和NO,恒温![]() 条件下反应,反应进行到不同时间测得各物质的浓度如下.
条件下反应,反应进行到不同时间测得各物质的浓度如下.
| NO |
|
|
0 |
| 0 | 0 |
10 |
|
|
|
20 |
|
|
|
30 |
|
|
|
40 |
|
|
|
50 |
|
|
|
①![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______
______ ![]() 保留两位小数
保留两位小数![]() .
.
②![]() 后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ______ ;
后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ______ ;
③若30min后升高温度至![]() ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、![]() 、
、![]() 的浓度之比为5:3:3,则该反应的
的浓度之比为5:3:3,则该反应的![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]()
(2)用![]() 催化还原氮氧化物可以消除氮氧化物的污染.已知:
催化还原氮氧化物可以消除氮氧化物的污染.已知:
①![]()
②![]()
③![]()
写出![]() 与
与![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 的热化学方程式 ______
的热化学方程式 ______
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的![]() ,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用
,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用![]() 外,还能得到一种复合肥料.
外,还能得到一种复合肥料.
①该复合肥料可能的化学式为 ______ ![]() 写出一种即可
写出一种即可![]() .
.
②若氨水与![]() 恰好完全反应生成正盐,则此时溶液呈 ______ 性
恰好完全反应生成正盐,则此时溶液呈 ______ 性![]() 填“酸”或“碱”
填“酸”或“碱”![]() .
.![]() 已知常温下:氨水
已知常温下:氨水![]() ,
,![]()
![]() ,
,![]() .
.![]()
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以![]() 和
和![]() 为原料制备HCOOH和
为原料制备HCOOH和![]() 的原理示意图.催化剂b表面发生的电极反应式为 ______
的原理示意图.催化剂b表面发生的电极反应式为 ______ ![]() 常温下,
常温下,![]() 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数![]() ______ .
______ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中lg![]() 与温度(t)的关系曲线如右图。下列说法正确的是
与温度(t)的关系曲线如右图。下列说法正确的是

A. 通过增高反应炉的高度,延长矿石和CO接触的时间,能减少尾气中CO的含量
B. CO不适宜用于工业冶炼金属Cr
C. CO还原PbO2的反应ΔH>0
D. 工业冶炼金属Cu时,高温有利于提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1) 若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L。样品中铝的质量是_____________g。
(2) 若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:________,氧化铁与铝的质量比是________。
(3) 待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c∶b=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的一组是( )
①.制取漂白液的反应原理: Cl2+2OH-=== Cl-+ClO-+ H2O
②.铁粉加入到三氯化铁溶液中: Fe3+ +Fe === 2Fe2+
③.NaHCO3溶液中加入稀盐酸:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
④.向澄清石灰水中加入少量小苏打溶液: Ca2++OH-+HCO3-=== CaCO3↓+H2O
⑤.硫酸铝溶液与足量的氨水混合反应: Al3+ + 4OH- === AlO2-+ H2O
⑥.过量氯水与FeCl2溶液作用: 2Fe2++Cl2 ==2 Fe3++2Cl-
A. ①②③ B. ③⑥ C. ①③⑥ D. ①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为______________、______________。
(3)农谚说的“粪和肥,肥料飞”指的是粪尿与草木灰搅和在一起会降低肥效。请你说明其中的化学原理:________________________。
(4)合成氨是生产氮肥的重要环节。合成氨生产简易流程示意图如下:

从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作?______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所得溶液的物质的量浓度等于0.1mol/L的是( )
A. 将0.1mol氨气充分溶解在1L水中
B. 将10g质量分数为98%的硫酸与990g水混合
C. 将8g三氧化硫溶于水并配成1L溶液
D. 将0.1mol氧化钾溶于水并配成1L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯,反应装置如图。下列对该实验的叙述错误的是
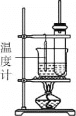
A.长玻璃管起冷凝回流作用
B.水浴加热其优点是受热均匀,便于控制温度
C.粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤
D.洗涤后,用无水CaCl2干燥,然后过滤,得到纯硝基苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com