
【题目】下列所得溶液的物质的量浓度等于0.1mol/L的是( )
A. 将0.1mol氨气充分溶解在1L水中
B. 将10g质量分数为98%的硫酸与990g水混合
C. 将8g三氧化硫溶于水并配成1L溶液
D. 将0.1mol氧化钾溶于水并配成1L溶液
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________。
(3)下列说法正确的是___________
a.电负性:As<Ga b.SiC与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。
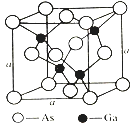
①晶胞中砷与镓原子间的化学键类型有___________。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________。
③一个晶胞的组成为___________。
④已知晶胞棱长a=5.64×10-10m,则该晶胞密度为ρ=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
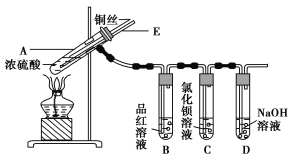
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为____________________________________________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_______________________________。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 | ________ | ________ |
写出其SO2表现还原性的离子反应方程式:______________________________________。
(4) 装置D的作用__________________________________________________________ 。
(5)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
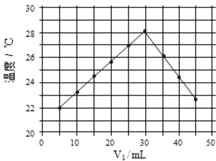
A. 做该实验时环境温度为22℃ B. 该实验表明热能可转化为化学能
C. NaOH溶液的浓度约为1.5mol·L-1 D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质都是人类重要的营养物质。回答下列问题:
(1)淀粉和纤维素是两种重要的多糖,这两种物质________(填“能”或“不能”互称为同分异构体,淀粉完全水解的化学方程式为______________。
(2)在常温常圧下、油脂既有呈固态的,也有呈液态的。某液态油脂的一种成分的结构简式为 ,则该油脂______(填“能”或“不能”)使溴水褪色,该油脂在热NaOH溶液中水解的产物有C17H35COONa、C17H33COONa、_____________。
,则该油脂______(填“能”或“不能”)使溴水褪色,该油脂在热NaOH溶液中水解的产物有C17H35COONa、C17H33COONa、_____________。
(3)发育出现障碍,患背养缺乏症,这主要是由摄入蛋白质不足引起的。蛋白质在人体内水解的最终产物是_______;向蛋白质溶液中加入(CH3COO)2Pb溶液会出现白色沉淀,该变化叫作_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L 0.4mol/L HN03溶液中加入Fe粉和Cu粉的混合物9g,充分反应,放出NO气体且金属有剩余。则反应后溶液中c(NO3-)为(忽略溶液体积的变化)
A. 0. 2mol/L B. 0.225 mol/L C. 0.3mol/L D. 0.325 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)在医药、化工、民用等方面有广泛的应用。回答下面问题:
(1)最早制备H2O2使用的原料是易溶于水的BaO2和稀硫酸,发生反应的化学方程式是____。
(2)目前工业制备H2O2的主要方法是蒽醌法。反应流程如下:

已知:乙基蒽醌是反应中的催化剂。
①蒽醌法所用原料的物质的量之比为____。
②操作a是____。
③再生回收液的成分是____。
(3)测量过氧化氢浓度常用的方法是滴定法,某次测定时,取20. 00mL过氧化氢样品,加入过量硫酸酸化,用0. l000mol/L的KMnO4标准溶液滴定至终点,消耗10. 00mL,滴定时发生反应的离子方程式为 ___,该样品中H2O2的物质的量浓度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com