
【题目】过氧化氢(H2O2)在医药、化工、民用等方面有广泛的应用。回答下面问题:
(1)最早制备H2O2使用的原料是易溶于水的BaO2和稀硫酸,发生反应的化学方程式是____。
(2)目前工业制备H2O2的主要方法是蒽醌法。反应流程如下:

已知:乙基蒽醌是反应中的催化剂。
①蒽醌法所用原料的物质的量之比为____。
②操作a是____。
③再生回收液的成分是____。
(3)测量过氧化氢浓度常用的方法是滴定法,某次测定时,取20. 00mL过氧化氢样品,加入过量硫酸酸化,用0. l000mol/L的KMnO4标准溶液滴定至终点,消耗10. 00mL,滴定时发生反应的离子方程式为 ___,该样品中H2O2的物质的量浓度为______。
【答案】BaO2+H2SO4===BaSO4↓+H2O21:1萃取分液有机溶剂乙基蒽醌2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O0.1250mol/L
【解析】
(l)易溶于水的BaO2和稀硫酸反应生成H2O2和BaSO4沉淀,发生反应的化学方程式是BaO2+H2SO4=BaSO4↓+H2O2;(2) ①根据反应原理可知,蒽醌法制备双氧水理论上消耗的原料是氧气和氢气,根据双氧水的化学式可知,原料的物质的量之比为1:1;②加入蒸馏水后进行操作a得到稀双氧水和再生回收液,根据流程原理再生回收液应该为乙基蒽醌,故操作是将乙基蒽醌从水中分离出来,应采用萃取分液;③再生回收液的成分是有机溶剂,乙基蒽醌;(3)双氧水在酸性条件下与KMnO4发生氧化还原反应,锰元素化合价由+7价降到+2价,O元素由-1价升高到0价,根据得失电子守恒、电荷守恒和原子守恒配平,滴定时发生反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O,根据反应可计算,样品中H2O2的物质的量浓度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列所得溶液的物质的量浓度等于0.1mol/L的是( )
A. 将0.1mol氨气充分溶解在1L水中
B. 将10g质量分数为98%的硫酸与990g水混合
C. 将8g三氧化硫溶于水并配成1L溶液
D. 将0.1mol氧化钾溶于水并配成1L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示晶体结构是一种具有优良的电压、电光等功能的晶体材料的最小结构单元(晶胞).晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
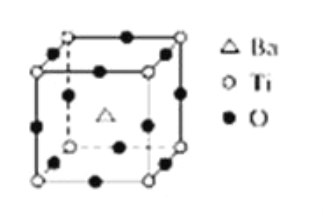
A. 8;BaTi8O12
B. 8;BaTi4O9
C. 6;BaTiO3
D. 3;BaTi2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下[以F-12 (二氯二氟甲烷)为例]:
CF2Cl2![]() CF2Cl+Cl
CF2Cl+Cl
Cl+O3→ClO+O2
ClO+ClO→ClOOCl(过氧化氯)
ClOOCl![]() 2Cl+O2
2Cl+O2
下列说法中不正确的是
A. 紫外线可以增大CF2Cl2的分解速率
B. ClO +ClO→ClOOCl的反应中有非极性键的形成
C. CF2Cl2是臭氧破坏反应的催化剂
D. 臭氧屡破坏的关键因素有:氟利昂,太阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
元素编号 | 元素特征信息 |
A | 最高正价和最低负价的绝对值之差为2 |
B | 原子核电荷数是内层电子数的4倍 |
C | 1molC单质能与冷水反应,在标准状况下生成11.2L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负二价阴离子的电子层结构与Ar原子相同 |
(1)E的简单离子的结构示意图为____________;
(2)C元素和A元素能化合形成C3A的化合物,该化合物化学式是__________;
(3)C和D简单离子的半径大小为____ >_____;(用离子符号表示)
(4)用两根玻璃棒分别蘸取A元素最高价氧化物对应水化物的浓溶液和A元素的氢化物的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 _____________________________ 。
(5)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中可行的是_________(填序号);
a.比较两种单质的颜色 b. 依据两元素在周期表中的位置
c.比较氢化物的稳定性 d.依据两元素单质在自然界中的存在状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们发现金星大气层有一种称之为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列推测不正确的是( )
A. COS是含有极性键的共价化合物B. COS的沸点比CO2高
C. COS 电子式为![]() D. COS中所有原子满足8电子稳定结构
D. COS中所有原子满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是( )
A. “千淘万漉虽辛苦,吹尽黄沙始到金”中“淘”“漉”相当于分离提纯操作中的“过滤”
B. 司母戊鼎属青铜制品,是我国古代科技光辉成就的代表之一
C. 瓷器(China)属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象
D. 侯德榜是我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有 相同的电子数,X元素可以组成M和N两种气态单质,反应M+2I-+2H+=I2+N+H2O常作为M的鉴定反应。
(1)M与N的摩尔质量之比为:______________________。
(2)写出实验室制取W2的离子方程式______________________。
(3)成都七中某化学兴趣小组设计下图所示的实验装置(图中夹持和加热装置略去),分别探究YX2和 W2的性质。

①分别通入YX2和W2时,在装置A中观察到的现象是否相同?___________(填“相同”或“不相同”)。若装置D中装的是铁粉,当通入W2时观察到的现象为______________________;若装置D中装的是五氧化二钒(V2O5),当通入YX2时,打开K放入适量的氧气,在D装置中发生反应的化学方程式为______________________。
②若装置B中装有5.0 mL 1.0×10-3 mol/L的碘水,当通入足量W2完全反应后,转移了 5.0×10-5 mol电 子,该反应的化学方程式为_________________________________。
(4)某同学将足量的YX2通入一支装有BaCl2溶液的试管,未见沉淀生成,向该试管中加入适量(填字母)___________,可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.CaCl2溶液
(5)若Y和X组成的负二价阴离子Z,Z中Y和X的质量比为Y:X =4:3,当W2与含Z的溶液完全反应后,有黄色沉淀生成,取上层淸液加入BaCl2溶液,有白色沉淀产生,且含硫微粒的物质的 量为1:1,该反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为____________。
(2)⑨在元素周期表中的位置是________________________。
(3)用电子式表示④元素与⑦元素形成化合物的过程________________________。
(4)可以用来验证④⑤两元素金属性强弱的实验是_______________________。(填字母代号)
(a)将在空气中放置已久的这两种元素的块状单质分别放入水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质分别和热水作用,并滴入酚酞
(d)均比较这两种元素的气态氢化物的稳定性
(5)⑥和⑦阴离子还原性较强的是(填微粒符号):____________用一个置换反应证实这一结论(写化学方程式)____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com