
����Ŀ��X��Y��WΪԭ���������ε����Ķ�����Ԫ�أ�X��Yͬ���壬Y��W����̬�⻯����� ��ͬ�ĵ�������XԪ�ؿ������M��N������̬���ʣ���ӦM+2I-+2H+=I2+N+H2O����ΪM�ļ�����Ӧ��
(1)M��N��Ħ������֮��Ϊ��______________________��
(2)д��ʵ������ȡW2�����ӷ���ʽ______________________��
(3)�ɶ�����ij��ѧ��ȤС�������ͼ��ʾ��ʵ��װ��(ͼ�мгֺͼ���װ����ȥ)���ֱ�̽��YX2�� W2�����ʡ�

�ٷֱ�ͨ��YX2��W2ʱ����װ��A�й۲쵽�������Ƿ���ͬ��___________(������ͬ����������ͬ��)����װ��D��װ�������ۣ���ͨ��W2ʱ�۲쵽������Ϊ______________________����װ��D��װ��������������(V2O5)����ͨ��YX2ʱ����K������������������Dװ���з�����Ӧ�Ļ�ѧ����ʽΪ______________________��
����װ��B��װ��5.0 mL 1.0��10-3 mol/L�ĵ�ˮ����ͨ������W2��ȫ��Ӧ��ת���� 5.0��10-5 mol�� �ӣ��÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________��
(4)ijͬѧ��������YX2ͨ��һ֧װ��BaCl2��Һ���Թܣ�δ���������ɣ�����Թ��м�������(����ĸ)___________�����Կ�����ɫ����������
A.��ˮ B.ϡ���� C.ϡ���� D.CaCl2��Һ
(5)��Y��X��ɵĸ�����������Z��Z��Y��X��������ΪY:X =4:3����W2�뺬Z����Һ��ȫ��Ӧ���л�ɫ�������ɣ�ȡ�ϲ�[Һ����BaCl2��Һ���а�ɫ�����������Һ����������ʵ� ��Ϊ1:1���÷�Ӧ�����ӷ���ʽΪ______________________��
���𰸡�3:2 MnO2+ 2Cl-+4H+![]() Mn2++Cl2��+2H2O ��ͬ �����ػ�ɫ���� 2SO2 +O2
Mn2++Cl2��+2H2O ��ͬ �����ػ�ɫ���� 2SO2 +O2 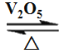 2SO3 5Cl2+I2+ 6H2O =2HIO3+10HCl AC Cl2+ S2O32-+ H2O=S��+ SO42-+ 2Cl-+2H+
2SO3 5Cl2+I2+ 6H2O =2HIO3+10HCl AC Cl2+ S2O32-+ H2O=S��+ SO42-+ 2Cl-+2H+
��������
X��Y��WΪԭ���������ε����Ķ�����Ԫ�أ�XԪ�ؿ������M��N������̬���ʣ���ӦM+2I-+2H+=I2+N+H2O����ΪM�ļ�����Ӧ����M����ǿ�����ԣ�Ӧ��Ϊ��������NΪ��������XΪOԪ�أ�X��Yͬ���壬��YΪSԪ�أ�Y��W����̬�⻯�������ͬ�ĵ���������ԭ������W����Y����WΪClԪ�أ��ݴ˷������
(1)���ݷ�������֪����MΪO3��NΪO2�����ߵ�Ħ������֮��Ϊ��48g/mol:32g/mol=3:2��
��ˣ�������ȷ���ǣ�3:2��
(2) W2ΪCl2ʵ������ȡ���������ӷ���ʽΪ��MnO2+ 2Cl-+4H+![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��
��ˣ�������ȷ���ǣ�MnO2+ 2Cl-+4H+![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��
(3) ��YX2��W2�ֱ�ΪSO2��Cl2����������ˮ���ɴ����ᣬ�������ܹ�Ư��Ʒ����Һ����������Ҳ�ܹ�Ư��Ʒ����Һ�����Էֱ�ͨ��SO2��Cl2ʱ����װ��A�й۲쵽��������ͬ��
��װ��D��װ�������ۣ���ͨ��Cl2ʱ�������������ȷ�Ӧ�����Ȼ�����������ػ�ɫ���̣�
���������ڴ���������������������Ӧ������������Ӧ�Ļ�ѧ����ʽΪ��2SO2 +O2 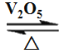 2SO3��
2SO3��
��ˣ�������ȷ����: ��ͬ�������ػ�ɫ���̣�2SO2 +O2 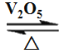 2SO3��
2SO3��
����װ��B��װ��5.0 mL 1.0��10-3 mol/L�ĵ�ˮ���ⵥ�ʵ����ʵ���Ϊ��5.0��10-6mol����ͨ��������Cl2��ȫ��Ӧ��,ת����5.0��10-5 mol���ӣ����Ԫ�ط�Ӧ�ϼ����ߵļ���Ϊ��![]() =5����Ӧ���Ԫ�صĻ��ϼ�Ϊ+5�ۣ����ɲ���ΪHIO3����÷�Ӧ�Ļ�ѧ����ʽΪ��5Cl2+I2+ 6H2O =2HIO3+10HCl��
=5����Ӧ���Ԫ�صĻ��ϼ�Ϊ+5�ۣ����ɲ���ΪHIO3����÷�Ӧ�Ļ�ѧ����ʽΪ��5Cl2+I2+ 6H2O =2HIO3+10HCl��
��ˣ�������ȷ���ǣ�5Cl2+I2+ 6H2O =2HIO3+10HCl��
(4)�����������Ȼ�����Ӧ����ijͬѧ��������SO2ͨ��һ֧װ��BaCl2��Һ���Թܣ�δ���������ɣ���ͨ�백�����������백����Ӧ��������������ӣ�������������뱵���ӷ�Ӧ���������ᱵ������������ϡ���ᣬϡ���Ὣ�����������������ᣬ�������Ȼ�����Ӧ�������ᱵ����������AC��ȷ��
��ˣ�������ȷ���ǣ�AC��
(5)��S��O��ɵĸ�����������Z��Z��S��O��������ΪY:X =4:3�����ߵ����ʵ���֮��Ϊ��![]() ��
��![]() =2:3����ZΪS2O32-����Cl2�뺬S2O32-����Һ��ȫ��Ӧ���л�ɫ�������ɣ�˵��������S������ȡ�ϲ���Һ����BaCl2��Һ���а�ɫ�������ɣ�˵����Ӧ����������������ӣ��Һ����������ʵ� ��Ϊ1:1����÷�Ӧ�����ӷ���ʽΪCl2+ S2O32-+ H2O=S��+ SO42-+ 2C-+2H+��
=2:3����ZΪS2O32-����Cl2�뺬S2O32-����Һ��ȫ��Ӧ���л�ɫ�������ɣ�˵��������S������ȡ�ϲ���Һ����BaCl2��Һ���а�ɫ�������ɣ�˵����Ӧ����������������ӣ��Һ����������ʵ� ��Ϊ1:1����÷�Ӧ�����ӷ���ʽΪCl2+ S2O32-+ H2O=S��+ SO42-+ 2C-+2H+��
��ˣ�������ȷ���ǣ�Cl2+ S2O32-+ H2O=S��+ SO42-+ 2Cl-+2H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L 0.4mol/L HN03��Һ�м���Fe�ۺ�Cu�۵Ļ����9g����ַ�Ӧ���ų�NO�����ҽ�����ʣ�ࡣ��Ӧ����Һ��c(NO3-)Ϊ��������Һ����ı仯��
A. 0. 2mol/L B. 0.225 mol/L C. 0.3mol/L D. 0.325 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(H2O2)��ҽҩ�����������õȷ����й㷺��Ӧ�á��ش��������⣺
��1�������Ʊ�H2O2ʹ�õ�ԭ����������ˮ��BaO2��ϡ���ᣬ������Ӧ�Ļ�ѧ����ʽ��____��
��2��Ŀǰ��ҵ�Ʊ�H2O2����Ҫ����������������Ӧ�������£�

��֪���һ������Ƿ�Ӧ�еĴ�����
������������ԭ�ϵ����ʵ���֮��Ϊ____��
�ڲ���a��____��
����������Һ�ijɷ���____��
��3��������������Ũ�ȳ��õķ����ǵζ�����ij�βⶨʱ��ȡ20. 00mL����������Ʒ��������������ữ����0. l000mol/L��KMnO4����Һ�ζ����յ㣬����10. 00mL���ζ�ʱ������Ӧ�����ӷ���ʽΪ ___������Ʒ��H2O2�����ʵ���Ũ��Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ����
A. �ױ��Ľṹ��ʽ��C7H8
B. ����������ʴ�����ĵ缫��Ӧʽ��O2+2H2O+4e��=4OH��
C. ̼��ĵ��뷽��ʽ��H2CO3 = H+ + HCO3��
D. Na2S��Һ��S2��ˮ������ӷ���ʽ��S2��+2H2O ![]() H2S +2OH��
H2S +2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����98%��Ũ���ᣨ��=1.84g/cm3������1mol/Lϡ����100mL��
��1��ʵ�������
a����100mL��Ͳ��ȡ98%��Ũ����___________mL��
b��ѡȡ��Ӧ��������ƿ��ϴ�ӣ�����Ƿ�©Һ����ϡ�Ͳ���ȴ�����µ�������Һ�ز�����ת�Ƶ�������ƿ�У�
c������������ˮϴ��С�ձ��Ͳ�����2--3�Σ�����ϴ��Һת�Ƶ�����ƿ�У�
d����С�ձ���ϡ��Ũ���ᣬϡ��ʱҪ�ò��������Ͻ��裻
e��������ƿ��ֱ�Ӽ�����ˮ����̶���1---2cm����
f����������ƿƿ����ҡ�ȣ�
g���ý�ͷ�ι�С�ļ�����ˮ���̶��ߣ�
h�������ƺõ���Һת���뺬��������ˮ���Լ�ƿ�����汸�ã�
��2��ʵ�������
����ȷ�IJ���������__________________________________________________������ţ���
�ڴ�ʵ���в�������������__________________________________________________��
��ʵ����������������������������ǣ�
I��____________________________________________________________��_____________________________________________��
��3�����в�����������Һ��Ũ���к�Ӱ�죿���ƫ�ߡ���ƫ�͡�����Ӱ�족��
I.��ȡŨ�������Ͳ������ˮϴ�����Σ�����ϴ��Һת������ƿ��______________��
II������ʱ��������ƿ�̶���__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�װ��ͼ�������У���ȷ����
A. ��ȡ���۲�Fe��OH��2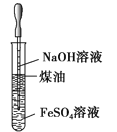
B. �Ƚ��������ʵ����ȶ���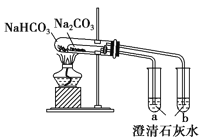
C. ʵ������ȡNH3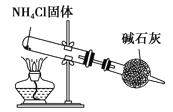
D. ����е㲻ͬ�һ��ܵ�Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��һ����Ҫ�Ļ���ԭ�ϣ����й��Ʊ�;����ͼ��ʾ������˵����ȷ����![]()

A. ;�������û�����H2SO4��HNO3���ʵ���֮�����Ϊ2��3
B. ����;�����Ʊ�16g����ͭ��������������ʵ���Ϊ0.1mL
C. ���ɵ���������ͭ������;���вμӷ�Ӧ����������ʵ�������=��=��
D. ��;���١�����ȣ�;���ڸ��õ���������ɫ��ѧ˼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ��֪�����ۻ���Ϊ6.0kJ��mol��1�������������Ϊ20kJmol��1������ÿĦ��������2mol��������ۻ�����ȫ���ڴ��Ʊ�������������ֻ���ƻ�����15%�����
B. ��֪һ���¶��£�������Һ�����ʵ���Ũ��Ϊc�������Ϊa��Ka=(ca)2/c(1��a)������ˮϡ�ͣ�����CH3COOH![]() CH3COO��+H+�����ƶ���a����Ka����
CH3COO��+H+�����ƶ���a����Ka����
C. ����ı�ȼ����Ϊ��890.3kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H=��890.3kJ��mol��1
D. 500����30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H=��38.6kJ��mol��1
2NH3(g) ��H=��38.6kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������![]() ��һ����Ҫ�ĺ�ͭ�����ij�����о�С���ô�ͭ(������
��һ����Ҫ�ĺ�ͭ�����ij�����о�С���ô�ͭ(������![]() )ͨ����ͬ�Ļ�ѧ��Ӧ��ȡ�����Ĺ�����ͼ��
)ͨ����ͬ�Ļ�ѧ��Ӧ��ȡ�����Ĺ�����ͼ��

���� | ��ȫ����ʱ��pH |
Fe(OH)3 | 3.2 |
Fe(OH)2 | 9.6 |
Cu(OH)2 | 6.4 |
����Һ�б��������ӵ����ʵ���Ũ��С��![]() ʱ����Ϊ�����ӳ�����ȫ��
ʱ����Ϊ�����ӳ�����ȫ��
�Իش��������⣺
��1�����������У����ʺ���Ϊ�Լ�X����________(�����)��
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
��2���ɴ�ͭͨ������;����ȡ��������;������ȣ�;���������Ե������ŵ㣬�ֱ���______________��____________________��
��3���Լ�Y������______________________(����һ�����ʵĻ�ѧʽ)��
��4������ҺC��![]() ��
��![]() ��Ũ�ȷֱ�Ϊ
��Ũ�ȷֱ�Ϊ![]() ��
��![]() ��������ҺC�м��������Լ�Y�Ĺ�����Ӧ������ҺC��pH��ΧԼΪ________��
��������ҺC�м��������Լ�Y�Ĺ�����Ӧ������ҺC��pH��ΧԼΪ________��
��5���⻯��ͭ![]() ��һ�ֺ�ɫ���壬40��50��ʱ����ҺE��
��һ�ֺ�ɫ���壬40��50��ʱ����ҺE��![]() ��Һ��Ϸ�Ӧ�ɵ��⻯��ͭ������ͬʱ�õ���������ᣬ�÷�Ӧ�����ӷ���ʽΪ___________________________________���÷�Ӧÿת��1.5
��Һ��Ϸ�Ӧ�ɵ��⻯��ͭ������ͬʱ�õ���������ᣬ�÷�Ӧ�����ӷ���ʽΪ___________________________________���÷�Ӧÿת��1.5![]() �����ӣ�����CuH�����ʵ���Ϊ________mol��
�����ӣ�����CuH�����ʵ���Ϊ________mol��
��/span>6������������ͭ![]() ��һ����;�㷺�Ĺ����ϣ��绯ѧ������ͭ����ʯī���缫�������ҺE�������������ͭ�����������������������ͭ����________��������
��һ����;�㷺�Ĺ����ϣ��绯ѧ������ͭ����ʯī���缫�������ҺE�������������ͭ�����������������������ͭ����________��������![]() �ĵ缫��ӦʽΪ______________________������������ҺE��Ũ��____________(������������������������С��)��
�ĵ缫��ӦʽΪ______________________������������ҺE��Ũ��____________(������������������������С��)��
��7���õ�![]() ���壬�Ҵ���������ˮϴ�Ӿ����Ŀ����______________��
���壬�Ҵ���������ˮϴ�Ӿ����Ŀ����______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com