
����Ŀ���±���Ԫ�����ڱ���һ���֣���ش��й����⣺
�������� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� |
(1)���л�ѧ��������õ�Ԫ�أ���ԭ�ӽṹʾ��ͼΪ____________��
(2)����Ԫ�����ڱ��е�λ����________________________��
(3)�õ���ʽ��ʾ��Ԫ�����Ԫ���γɻ�����Ĺ���________________________��
(4)����������֤�ܢ���Ԫ�ؽ�����ǿ����ʵ����_______________________��(����ĸ����)
(a)���ڿ����з����Ѿõ�������Ԫ�صĿ�״���ʷֱ����ˮ��
(b)����״����С��ͬ��������Ԫ�صĵ��ʷֱ��ͬŨ�ȵ����ᷴӦ
(c)����״����С��ͬ����Ԫ�صĵ��ʷֱ����ˮ���ã��������̪
(d)���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
(5)�͢������ӻ�ԭ�Խ�ǿ����(��������)��____________��һ���û���Ӧ֤ʵ��һ����(д��ѧ����ʽ)____________________________________��
���𰸡� �������ڵ�IA��
�������ڵ�IA�� ![]() bc S2- Cl2+Na2S=2NaCl+S��
bc S2- Cl2+Na2S=2NaCl+S��
��������
����Ԫ�����ڱ��ֱ��ƶϳ��١����Ԫ�طֱ�ΪC��N��F��Mg��Al��S��Cl��Ar��K��Br��
��1��ϡ���������������ã�
��2��K��ԭ�ӽṹ����4�����Ӳ㡢����������Ϊ1��
��3��������γɵĻ�����Ϊ�Ȼ�þ��Ϊ���ӻ����
��4���ɽ��������ˮ�ķ�Ӧ����Ӧ��ļ��ԡ���������֮����û���Ӧ�ȱȽϽ����ԣ�
��5���ǽ�����Խǿ����Ӧ�����ӵĻ�ԭ��Խ�������ɷǽ�������֮����û���Ӧ˵����
��Ԫ�������ڱ���λ�ÿ�֪���١���ֱ�ΪC��N��F��Mg��Al��S��Cl��Ar��K��Br��
��1�����л�ѧ��������õ�Ԫ��ΪAr����ԭ�ӽṹʾ��ͼΪ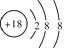 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2�����Ԫ����K����Ԫ�����ڱ��е�λ���ǵ������ڵڢ�A�壬�ʴ�Ϊ���������ڵڢ�A�壻
��3��������γɵĻ�����Ϊ�Ȼ�þ���Ȼ�þΪ���ӻ�����������γ����Ӽ������γɹ���Ϊ![]() ��
��
�ʴ�Ϊ��![]() ��
��
��4��a�����ڿ����з����Ѿõ�������Ԫ�صĿ�״���ʷֱ����ˮ�У��������ܱ����������ܱȽϽ����ԣ��ʲ�ѡ��
b������״����С��ͬ��������Ԫ�صĵ��ʷֱ��ͬŨ�ȵ����ᷴӦ����Ӧ���ҵĶ�Ӧ�����Ľ�����ǿ����ѡ��
c������״����С��ͬ��������Ԫ�صĵ��ʷֱ���¶���ͬ����ˮ���ã��������̪����Ӧ�����Һ�ɫ���˵������ǿ����Ӧ�����Ľ�����Խǿ���ɱȽϽ����ԣ���ѡ��
d���Ƚ�������Ԫ�ص��⻯����ȶ��ԣ��ɱȽϷǽ����Ե�ǿ�����ʲ�ѡ��
�ʴ�Ϊ��bc��
��5���ǽ�����S��Cl����ޢ�����Ԫ�صļ������ӻ�ԭ�Խ�ǿ����S2-����Na2S+Cl2��2NaCl+S����˵�����ʴ�Ϊ��S2-��Na2S+Cl2��2NaCl+S����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(H2O2)��ҽҩ�����������õȷ����й㷺��Ӧ�á��ش��������⣺
��1�������Ʊ�H2O2ʹ�õ�ԭ����������ˮ��BaO2��ϡ���ᣬ������Ӧ�Ļ�ѧ����ʽ��____��
��2��Ŀǰ��ҵ�Ʊ�H2O2����Ҫ����������������Ӧ�������£�

��֪���һ������Ƿ�Ӧ�еĴ�����
������������ԭ�ϵ����ʵ���֮��Ϊ____��
�ڲ���a��____��
����������Һ�ijɷ���____��
��3��������������Ũ�ȳ��õķ����ǵζ�����ij�βⶨʱ��ȡ20. 00mL����������Ʒ��������������ữ����0. l000mol/L��KMnO4����Һ�ζ����յ㣬����10. 00mL���ζ�ʱ������Ӧ�����ӷ���ʽΪ ___������Ʒ��H2O2�����ʵ���Ũ��Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��һ����Ҫ�Ļ���ԭ�ϣ����й��Ʊ�;����ͼ��ʾ������˵����ȷ����![]()

A. ;�������û�����H2SO4��HNO3���ʵ���֮�����Ϊ2��3
B. ����;�����Ʊ�16g����ͭ��������������ʵ���Ϊ0.1mL
C. ���ɵ���������ͭ������;���вμӷ�Ӧ����������ʵ�������=��=��
D. ��;���١�����ȣ�;���ڸ��õ���������ɫ��ѧ˼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ��֪�����ۻ���Ϊ6.0kJ��mol��1�������������Ϊ20kJmol��1������ÿĦ��������2mol��������ۻ�����ȫ���ڴ��Ʊ�������������ֻ���ƻ�����15%�����
B. ��֪һ���¶��£�������Һ�����ʵ���Ũ��Ϊc�������Ϊa��Ka=(ca)2/c(1��a)������ˮϡ�ͣ�����CH3COOH![]() CH3COO��+H+�����ƶ���a����Ka����
CH3COO��+H+�����ƶ���a����Ka����
C. ����ı�ȼ����Ϊ��890.3kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H=��890.3kJ��mol��1
D. 500����30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H=��38.6kJ��mol��1
2NH3(g) ��H=��38.6kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����������ʵ���Һ����μ�������������Һ�������ɰ�ɫ��������������ܽ⣬���������ǣ� ��
A.����þB.���ǻ���������C.�Ȼ���D.�Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��Ӧ�У��跴Ӧ���������ΪE1���������������ΪE2��
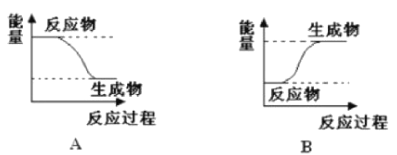
(1)��E1>E2����÷�ӦΪ_____________(��������������������)��Ӧ���÷�Ӧ����ͼ_____________(����A������B��)��ʾ��
(2)��E1��E2����÷�ӦΪ_____________(��������������������)��Ӧ���÷�Ӧ����ͼ___________(����A������B��)��ʾ
(3)̫���ܵĿ�����������21���͵�һ����Ҫ���⡣
�����ô��ܽ��ʴ���̫���ܵ�ԭ���ǰ�����̫�������£�ij�����ۻ����������������������ͷų���Ӧ�������Ӷ�ʹ���µ��Ե��ڡ���֪�������ݣ�
�� | �۵�/�� | �ۻ�����KJ��mol-1 | �ο��۸�/Ԫ |
CaCl2��6H2O | 29.0 | 37.3 | 780850 |
Na2SO4��l0H2O | 32.4 | 77.0 | 800900 |
Na2HPO4��12H2O | 36.1 | 100.1 | 1600-2000 |
Na2S2O3��5H2O | 48.5 | 49.7 | 1400-1800 |
���������������ܽ��ʵ�һ������_____________(����ĸ)��
A CaCl2��6H2O
B Na2SO4��l0H2O
C Na2HPO4��12H2O
D Na2S2O3��5H2O
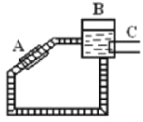
��ͼ��һ��̫������ˮ����ʾ��ͼ��ͼ��A�Ǽ�������B�Ǵ�ˮ������C�ǹ�����ʱ���ȵĸ��������������ݶ�ˮ���ܶȵ���ʶ�������������������ˮ����_________(����˳����������)ʱ�뷽��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��500 mL NaNO3��Cu(NO3)2�Ļ����Һ��c(NO![]() )��6 mol/L����ʯī���缫������Һ����ͨ��һ��ʱ����������ռ�������22.4 L(��״����)���ٶ�������Һ�����Ϊ500 mL������˵����ȷ����( )
)��6 mol/L����ʯī���缫������Һ����ͨ��һ��ʱ����������ռ�������22.4 L(��״����)���ٶ�������Һ�����Ϊ500 mL������˵����ȷ����( )
A��ԭ�����Һ��c(Na��)��6 mol
B������õ���Cu�����ʵ���Ϊ2 mol
C�������������й�ת��8 mol����
D��������Һ��c(H��)��4 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������![]() ��һ����Ҫ�ĺ�ͭ�����ij�����о�С���ô�ͭ(������
��һ����Ҫ�ĺ�ͭ�����ij�����о�С���ô�ͭ(������![]() )ͨ����ͬ�Ļ�ѧ��Ӧ��ȡ�����Ĺ�����ͼ��
)ͨ����ͬ�Ļ�ѧ��Ӧ��ȡ�����Ĺ�����ͼ��

���� | ��ȫ����ʱ��pH |
Fe(OH)3 | 3.2 |
Fe(OH)2 | 9.6 |
Cu(OH)2 | 6.4 |
����Һ�б��������ӵ����ʵ���Ũ��С��![]() ʱ����Ϊ�����ӳ�����ȫ��
ʱ����Ϊ�����ӳ�����ȫ��
�Իش��������⣺
��1�����������У����ʺ���Ϊ�Լ�X����________(�����)��
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
��2���ɴ�ͭͨ������;����ȡ��������;������ȣ�;���������Ե������ŵ㣬�ֱ���______________��____________________��
��3���Լ�Y������______________________(����һ�����ʵĻ�ѧʽ)��
��4������ҺC��![]() ��
��![]() ��Ũ�ȷֱ�Ϊ
��Ũ�ȷֱ�Ϊ![]() ��
��![]() ��������ҺC�м��������Լ�Y�Ĺ�����Ӧ������ҺC��pH��ΧԼΪ________��
��������ҺC�м��������Լ�Y�Ĺ�����Ӧ������ҺC��pH��ΧԼΪ________��
��5���⻯��ͭ![]() ��һ�ֺ�ɫ���壬40��50��ʱ����ҺE��
��һ�ֺ�ɫ���壬40��50��ʱ����ҺE��![]() ��Һ��Ϸ�Ӧ�ɵ��⻯��ͭ������ͬʱ�õ���������ᣬ�÷�Ӧ�����ӷ���ʽΪ___________________________________���÷�Ӧÿת��1.5
��Һ��Ϸ�Ӧ�ɵ��⻯��ͭ������ͬʱ�õ���������ᣬ�÷�Ӧ�����ӷ���ʽΪ___________________________________���÷�Ӧÿת��1.5![]() �����ӣ�����CuH�����ʵ���Ϊ________mol��
�����ӣ�����CuH�����ʵ���Ϊ________mol��
��/span>6������������ͭ![]() ��һ����;�㷺�Ĺ����ϣ��绯ѧ������ͭ����ʯī���缫�������ҺE�������������ͭ�����������������������ͭ����________��������
��һ����;�㷺�Ĺ����ϣ��绯ѧ������ͭ����ʯī���缫�������ҺE�������������ͭ�����������������������ͭ����________��������![]() �ĵ缫��ӦʽΪ______________________������������ҺE��Ũ��____________(������������������������С��)��
�ĵ缫��ӦʽΪ______________________������������ҺE��Ũ��____________(������������������������С��)��
��7���õ�![]() ���壬�Ҵ���������ˮϴ�Ӿ����Ŀ����______________��
���壬�Ҵ���������ˮϴ�Ӿ����Ŀ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���طŵ�ʱ�ķ�Ӧ��PbO2+Pb+2H2SO4�T2PbSO4+2H2O�������йطŵ�ʱ��˵����ȷ���ǣ�������
A. �����ĵ缫��Ӧʽ�ǣ�Pb+SO42����2e���TPbSO4
B. PbO2���������缫����������Ӧ
C. ��ת�Ƶĵ�����Ϊ3.01��1023ʱ�����뷴Ӧ��Pb������Ϊ103.5 g
D. ��Һ��H+����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com