
����Ŀ��ijʵ��С��ͬѧΪ��̽��ͭ��Ũ����ķ�Ӧ������������ʵ�飬ʵ��װ����ͼ��ʾ��
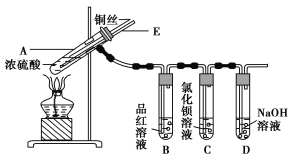
ʵ�鲽�裺
����������ͼ��ʾ��װ�ã����������ԣ��ټ����Լ���
�ڼ���A�Թܣ���B�Թ���Ʒ����Һ��ɫ��Ϩ��ƾ��ƣ�
�۽�Cu˿���ϳ鶯�뿪Һ�档
��ش��������⣺
(1)A�Թ��з�����Ӧ�Ļ�ѧ����ʽΪ____________________________________________��
(2)�ܹ�֤��ͭ��Ũ���ᷴӦ���������ʵ��������_______________________________��
(3)��ʢ��BaCl2��Һ��C�Թ��У����˵��ܿ��������⣬���������������������е���Һ�ֳ����ݣ��ֱ�μ�������Һ�������������Ļ�ѧʽ������ж�Ӧ��λ�á�
�μӵ���Һ | ��ˮ | ��ˮ |
�����Ļ�ѧʽ | ________ | ________ |
д����SO2���ֻ�ԭ�Ե����ӷ�Ӧ����ʽ��______________________________________��
(4) װ��D������__________________________________________________________ ��
(5)ʵ����Ϻ���Ϩ��ƾ��ƣ����ڵ���E�Ĵ��ڣ��Թ�B�е�Һ�岻�ᵹ�����Թ�A�У���ԭ����_________________________________________________________________��
���𰸡�Cu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O B�Թ���Ʒ����Һ��ɫ BaSO4 BaSO3 SO2��Cl2��2H2O===4H����SO42-��2Cl��(��Ba2����SO2��Cl2��2H2O===BaSO4����4H����2Cl��) ��ȥʣ���SO2(��β������) ��A�Թ�������ѹǿ��Сʱ��������E���ܽ���A�Թ��У�ά��A�Թ���ѹǿƽ��
CuSO4��SO2����2H2O B�Թ���Ʒ����Һ��ɫ BaSO4 BaSO3 SO2��Cl2��2H2O===4H����SO42-��2Cl��(��Ba2����SO2��Cl2��2H2O===BaSO4����4H����2Cl��) ��ȥʣ���SO2(��β������) ��A�Թ�������ѹǿ��Сʱ��������E���ܽ���A�Թ��У�ά��A�Թ���ѹǿƽ��
��������
����ʵ��ԭ������Ӧ������ʷ�����Ӧ�����з����ķ�Ӧ�����ݶ�����������ʷ�������д��ط���ʽ������ʵ��װ�÷������������ú�ԭ����
(1)A�Թ��з�������Cu��Ũ��������SO2�ķ�Ӧ��Cu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O���ʴ�Ϊ��Cu��2H2SO4(Ũ)
CuSO4��SO2����2H2O���ʴ�Ϊ��Cu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O��
CuSO4��SO2����2H2O��
(2)����SO2��ʹƷ����Һ��ɫ��������֤��Cu��Ũ���ᷴӦ������SO2���壬
�ʴ�Ϊ��B�Թ���Ʒ����Һ��ɫ��
(3)��ˮ�е�Cl2���������ԣ��ܽ�SO2����ΪSO42-��SO42-��Ba2����Ӧ����BaSO4��������ˮ���м��ԣ�����SO2����SO32-��SO32-��Ba2����Ӧ����BaSO3������������������ԭ���ķ�ӦΪ��SO2��Cl2��2H2O===4H����SO42-��2Cl����
�ʴ�Ϊ�� BaSO4 �� BaSO3��SO2��Cl2��2H2O===4H����SO42-��2Cl��(��Ba2����SO2��Cl2��2H2O===BaSO4����4H����2Cl��)��
(4)��Ӧ���ɵĶ��������ж���Dװ���е�����������Һ�������ն�������
�ʴ�Ϊ�� ��ȥʣ���SO2(��β������) ��
(5)����װ���ص�����õ�A�Թ�������ѹǿ��Сʱ��������E���ܽ���A�Թ��У�ά��A�Թ���ѹǿƽ�⣬
�ʴ�Ϊ����A�Թ�������ѹǿ��Сʱ��������E���ܽ���A�Թ��У�ά��A�Թ���ѹǿƽ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʷ��ÿһ���ش��ֶ�������ƽ��˿�ѧ�ķ�չ��������ѧ���Ž��з�Ի�ѧ��ͻ���������ڣ�������
A.������Ԫ��������B.�����ԭ�ӷ���ѧ˵
C.��ʾ��ȼ�յı���D.��ȡ����űҩ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijѧУ����������Լ���ǩ�ϵIJ������ݣ��ݴ�����˵����ȷ���ǣ� ��

A. ����������ʵ���Ũ��Ϊ1.84mol/L
B. 1mol Zn�������ĸ����ᷴӦ����2gH2
C. ����200mL 4.6mol/L��ϡ������ȡ������50mL
D. ��������������ˮ���������Һ�����ʵ���Ũ�ȵ���9.2mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������NaOH��Һ����μ���AlCl3��Һ�����ɳ���Al(OH)3������AlCl3�������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ����������
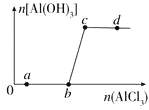
A. a���Ӧ����Һ�У�Na����Fe3����SO42-��HCO3-
B. b���Ӧ����Һ�У�Ag����Ca2����NO3-��F��
C. c���Ӧ����Һ�У�Na����S2����SO42-��Cl��
D. d���Ӧ����Һ�У�K����NH4+��I����CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ZnS���ж��صĹ��ЧӦ���ڵ�ѧ����ѧ����ѧ������Ӧ�ù㷺���Թ�ҵ����п��(��Ҫ�ɷ�ΪZn��ZnO��������Fe2O3��FeO��CuO������)Ϊԭ���Ʊ�����ZnS�Ĺ�ҵ��������:

��ش��������⡣
��1�����ʱFeO��ϡHNO3��Ӧ�����ӷ���ʽ_______________________��
��2���������β��ѭ�����ã������X���������____________________________��
��3�������м���ZnO��pH��Ŀ����__________________________________________��
��4������2�еijɷ���___________________��
��5����֪ZnS���ܶȻ�Ksp=1.6��10-24,��Һ��Zn2+Ũ��Ϊ0.01mol/L������Һ��S2-Ũ�ȴ���______mol/L��������ZnS������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����ȷ�Ӧ��װ��ͼ���Ը÷�Ӧ������ȷ���ǣ� ��
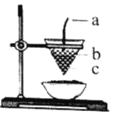
A. ͼ��aΪþ����bΪKClO3��cΪAl2O3��Fe�Ļ����
B. ���ȷ�Ӧ�Ƿ��ȷ�Ӧ�����Գ����¿��Է�����Ӧ
C. KClO3�Ǹ÷�Ӧ�Ĵ���
D. �������ȷ�Ӧ�ɺ��Ӹֹ죬Ҳ��ұ���̵����۽���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I��C11H12O3�����Ʊ�Һ�����ϵ��м���֮һ��������к���ȩ����������I������E��H��һ�������ºϳɣ�
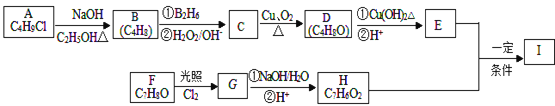
��֪������Ϣ��
��A�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣻
��R��CH=CH2![]() R��CH2CH2OH��
R��CH2CH2OH��
�ۻ�����F�����ϵ�һ�ȴ���ֻ�����֣�
��ͨ����ͬһ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ���
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ___________________________
��2��D�Ľṹ��ʽΪ__________________________
��3��E�еĹ���������Ϊ__________________
��4��F����G�Ļ�ѧ����ʽΪ________________________________________���÷�Ӧ����Ϊ_____________________________��
��5��I�Ľṹ��ʽΪ______________________________��
��6��I��ͬϵ��J��I��Է�������С14��J��ͬ���칹������ͬʱ���������������ٱ�����ֻ������ȡ�������ڼ��ܷ���������Ӧ�������뱥��NaHCO3��Һ��Ӧ�ų�CO2������____�֣������������칹����J��һ��ͬ���칹�巢��������Ӧ���ữ��˴Ź�������Ϊ����壬�ҷ������Ϊ2:2:1��д��J������ͬ���칹��Ľṹ��ʽ_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼʾ��Ԫ�����ڱ���һ���֣�A��B��C��Ϊ������Ԫ�أ�A��C����Ԫ�ص�ԭ�Ӻ��������֮�͵���B����������B��ԭ�Ӻ�������������������ȡ��ش�
![]()
��1��д��Ԫ�ط��ţ�A_________��B______��C_________��
��2��C��ԭ�ӽṹʾ��ͼ��__________��B������������Ӧˮ����Ļ�ѧʽΪ_________��
��3��A���⻯���ˮ��Һ��______��������ԡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com