
ЁОЬтФПЁПЛЏКЯЮяIЃЈC11H12O3ЃЉЪЧжЦБИвКОЇВФСЯЕФжаМфЬхжЎвЛЃЌЦфЗжзгжаКЌгаШЉЛљКЭѕЅЛљЃЎIПЩвдгУEКЭHдквЛЖЈЬѕМўЯТКЯГЩЃК
вбжЊвдЯТаХЯЂЃК
ЂйAЕФКЫДХЙВеёЧтЦзБэУїЦфжЛгавЛжжЛЏбЇЛЗОГЕФЧтЃЛ
ЂкRЉCH=CH2![]() RЉCH2CH2OHЃЛ
RЉCH2CH2OHЃЛ
ЂлЛЏКЯЮяFБНЛЗЩЯЕФвЛТШДњЮяжЛгаСНжжЃЛ
ЂмЭЈГЃдкЭЌвЛИіЬМдзгЩЯСЌгаСНИієЧЛљВЛЮШЖЈЃЌвзЭбЫЎаЮГЩєЪЛљЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉAЕФЛЏбЇУћГЦЮЊ___________________________
ЃЈ2ЃЉDЕФНсЙЙМђЪНЮЊ__________________________
ЃЈ3ЃЉEжаЕФЙйФмЭХУћГЦЮЊ__________________
ЃЈ4ЃЉFЩњГЩGЕФЛЏбЇЗНГЬЪНЮЊ________________________________________ЃЌИУЗДгІРраЭЮЊ_____________________________ЁЃ
ЃЈ5ЃЉIЕФНсЙЙМђЪНЮЊ______________________________ЁЃ
ЃЈ6ЃЉIЕФЭЌЯЕЮяJБШIЯрЖдЗжзгжЪСПаЁ14ЃЌJЕФЭЌЗжвьЙЙЬхжаФмЭЌЪБТњзуШчЯТЬѕМўЃКЂйБНЛЗЩЯжЛгаСНИіШЁДњЛљЃЌЂкМШФмЗЂЩњвјОЕЗДгІЃЌгжФмгыБЅКЭNaHCO3ШмвКЗДгІЗХГіCO2ЃЌЙВга____жжЃЈВЛПМТЧСЂЬхвьЙЙЃЉЁЃJЕФвЛИіЭЌЗжвьЙЙЬхЗЂЩњвјОЕЗДгІВЂЫсЛЏКѓКЫДХЙВеёЧтЦзЮЊШ§зщЗхЃЌЧвЗхУцЛ§БШЮЊ2:2:1ЃЌаДГіJЕФетжжЭЌЗжвьЙЙЬхЕФНсЙЙМђЪН_________
ЁОД№АИЁП 2ЉМзЛљЉ2ЉТШБћЭщ ЃЈCH3ЃЉ2CHCHO єШЛљ 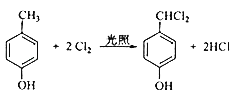 ШЁДњЗДгІ
ШЁДњЗДгІ 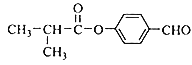 18
18 ![]()
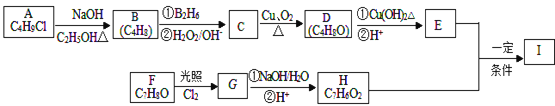
ЁОНтЮіЁПAЕФЗжзгЪНЮЊC4H9ClЃЌКЫДХЙВеёЧтЦзБэУїЦфжЛгавЛжжЛЏбЇЛЗОГЕФЧтЃЌдђAЮЊ(CH3)3CClЃЌдкЧтбѕЛЏФЦДМШмвКЁЂМгШШЬѕМўЯТЗЂЩњЯћШЅЗДгІЃЌЩњГЩBЮЊCH2=C(CH3)2ЃЌBЗЂЩњаХЯЂ2жаЕФЗДгІЩњГЩCЮЊ(CH3)2CHCH2OHЃЌCЗЂЩњДпЛЏбѕЛЏЩњГЩDЮЊ(CH3)2CHCHOЃЌDдйгыЧтбѕЛЏЭЗДгІЃЌЫсЛЏЕУЕНEЮЊ(CH3)2CHCOOHЃЌFЕФЗжзгЪНЮЊC7H8OЃЌБНЛЗЩЯЕФвЛТШДњЮяжЛгаСНжжЃЌгІКЌга2ИіВЛЭЌЕФВрСДЃЌЧвДІгкЖдЮЛЃЌдђFЮЊ![]() ЃЌгыТШЦјдкЙтееЬѕМўЯТЗЂЩњШЁДњЗДгІЃЌЩњГЩGЮЊ
ЃЌгыТШЦјдкЙтееЬѕМўЯТЗЂЩњШЁДњЗДгІЃЌЩњГЩGЮЊ![]() ЃЌGдкЧтбѕЛЏФЦЫЎШмвКжаЗЂЩњЫЎНтЗДгІЃЌЫсЛЏЕУЕНHЃЌгЩгкЭЌвЛИіЬМдзгЩЯСЌгаСНИієЧЛљВЛЮШЖЈЃЌвзЭбЫЎаЮГЩєЪЛљЃЌЙЪHЮЊ
ЃЌGдкЧтбѕЛЏФЦЫЎШмвКжаЗЂЩњЫЎНтЗДгІЃЌЫсЛЏЕУЕНHЃЌгЩгкЭЌвЛИіЬМдзгЩЯСЌгаСНИієЧЛљВЛЮШЖЈЃЌвзЭбЫЎаЮГЩєЪЛљЃЌЙЪHЮЊ![]() ЃЌHгыEЗЂЩњѕЅЛЏЗДгІЩњГЩIЃЌЦфЗжзгжаКЌгаШЉЛљКЭѕЅЛљЃЌЙЪIЮЊ
ЃЌHгыEЗЂЩњѕЅЛЏЗДгІЩњГЩIЃЌЦфЗжзгжаКЌгаШЉЛљКЭѕЅЛљЃЌЙЪIЮЊ![]() ЁЃ
ЁЃ
(1). гЩЩЯЪіЗжЮіПЩжЊЃЌAЮЊ(CH3)3CClЃЌЛЏбЇУћГЦЮЊ2-МзЛљ-2-ТШБћЭщЃЌЙЪД№АИЮЊЃК2-МзЛљ-2-ТШБћЭщЃЛ
(2). гЩЩЯЪіЗжЮіПЩжЊЃЌDЕФНсЙЙМђЪНЮЊ(CH3)2CHCHOЃЌЙЪД№АИЮЊЃК(CH3)2CHCHOЃЛ
(3). EЮЊ(CH3)2CHCOOHЃЌEжаЕФЙйФмЭХЮЊєШЛљЃЌЙЪД№АИЮЊЃКєШЛљЃЛ
(4). FгыТШЦјЗЂЩњШЁДњЗДгІЩњГЩGЃЌЛЏбЇЗНГЬЪНЮЊ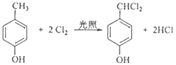 ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК ЃЛШЁДњЗДгІЃЛ
ЃЛШЁДњЗДгІЃЛ
(5). гЩЩЯЪіЗжЮіПЩжЊЃЌIЕФНсЙЙМђЪНЮЊ![]() ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
(6). I(![]() )ЕФЭЌЯЕЮяJБШIЯрЖдЗжзгжЪСПаЁ14ЃЌЫЕУїJБШIЩйвЛИіCH2дзгЭХЃЌJЕФЭЌЗжвьЙЙЬхжаФмЭЌЪБТњзуШчЯТЬѕМўЃКЂйБНЛЗЩЯжЛгаСНИіШЁДњЛљЃЌЂкМШФмЗЂЩњвјОЕЗДгІЃЌгжФмгыБЅКЭNaHCO3ШмвКЗДгІЗХГіCO2ЃЌдђJЕФЭЌЗжвьЙЙЬхжаКЌгаШЉЛљКЭєШЛљЃЌВрСДПЩФмЮЊЃК-CHOКЭ-CH2CH2COOHЁЂ-CHOКЭ-CH(CH3)COOHЁЂ-CH2CHOКЭ-CH2COOHЁЂ-CH2CH2CHOКЭ-COOHЁЂ-CH(CH3)CHOКЭ-COOHЁЂ-CH3КЭ-CH(CHO)COOHЃЌИїгаСкЁЂМфЁЂЖдШ§жжЮЛжУЃЌдђЗћКЯЬѕМўЕФЭЌЗжвьЙЙЬхга6ЁС3=18жжЃЌJЕФвЛИіЭЌЗжвьЙЙЬхЗЂЩњвјОЕЗДгІВЂЫсЛЏКѓКЫДХЙВеёЧтЦзЮЊШ§зщЗхЃЌЧвЗхУцЛ§БШЮЊ2:2:1ЃЌЖјJЕФЭЌЗжвьЙЙЬхЗЂЩњвјОЕЗДгІВЂЫсЛЏКѓЕФВњЮяБНЛЗВрСДжСЩйга2жжHдзгЃЌдђВњЮяжаБНЛЗЩЯжЛга1жжHдзгЃЌВњЮяга2Иі-COOHЃЌгІЛЙКЌга2Иі-CH2-ЃЌ2ИіВрСДЯрЭЌЧвДІгкЖдЮЛЃЌВњЮяжаВрСДЮЊ-CH2COOHЃЌдђЗћКЯЬѕМўЕФЭЌЗжвьЙЙЬхНсЙЙМђЪНЮЊЃК
)ЕФЭЌЯЕЮяJБШIЯрЖдЗжзгжЪСПаЁ14ЃЌЫЕУїJБШIЩйвЛИіCH2дзгЭХЃЌJЕФЭЌЗжвьЙЙЬхжаФмЭЌЪБТњзуШчЯТЬѕМўЃКЂйБНЛЗЩЯжЛгаСНИіШЁДњЛљЃЌЂкМШФмЗЂЩњвјОЕЗДгІЃЌгжФмгыБЅКЭNaHCO3ШмвКЗДгІЗХГіCO2ЃЌдђJЕФЭЌЗжвьЙЙЬхжаКЌгаШЉЛљКЭєШЛљЃЌВрСДПЩФмЮЊЃК-CHOКЭ-CH2CH2COOHЁЂ-CHOКЭ-CH(CH3)COOHЁЂ-CH2CHOКЭ-CH2COOHЁЂ-CH2CH2CHOКЭ-COOHЁЂ-CH(CH3)CHOКЭ-COOHЁЂ-CH3КЭ-CH(CHO)COOHЃЌИїгаСкЁЂМфЁЂЖдШ§жжЮЛжУЃЌдђЗћКЯЬѕМўЕФЭЌЗжвьЙЙЬхга6ЁС3=18жжЃЌJЕФвЛИіЭЌЗжвьЙЙЬхЗЂЩњвјОЕЗДгІВЂЫсЛЏКѓКЫДХЙВеёЧтЦзЮЊШ§зщЗхЃЌЧвЗхУцЛ§БШЮЊ2:2:1ЃЌЖјJЕФЭЌЗжвьЙЙЬхЗЂЩњвјОЕЗДгІВЂЫсЛЏКѓЕФВњЮяБНЛЗВрСДжСЩйга2жжHдзгЃЌдђВњЮяжаБНЛЗЩЯжЛга1жжHдзгЃЌВњЮяга2Иі-COOHЃЌгІЛЙКЌга2Иі-CH2-ЃЌ2ИіВрСДЯрЭЌЧвДІгкЖдЮЛЃЌВњЮяжаВрСДЮЊ-CH2COOHЃЌдђЗћКЯЬѕМўЕФЭЌЗжвьЙЙЬхНсЙЙМђЪНЮЊЃК![]() ЃЌЙЪД№АИЮЊЃК18ЃЛ
ЃЌЙЪД№АИЮЊЃК18ЃЛ![]() ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПI.ФГЬНОПаЁзщдкЪЕбщЪвжагУТСЭСПѓ(жївЊГЩЗжЮЊAl2O3ЃЌЛЙКЌгаFe2O3ЁЂSiO2)ЬсШЁбѕЛЏТСЁЃЛиД№ЯТСаЮЪЬтЃК

(1)дкЪЕбщжаашгУ1 molЁЄLЃ1ЕФNaOHШмвК480 mLЃЌХфжЦИУШмвКвбгаЯТСавЧЦїЃКЩеБЁЂЭаХЬЬьЦН(эРТы)ЁЂНКЭЗЕЮЙмЁЂвЉГзЁЂВЃСЇАєЃЌЛЙШБЩйЕФвЧЦїЪЧ______________ЁЃ
(2)аДГіВНжшЂйжаЗЂЩњЗДгІЕФРызгЗНГЬЪН___________
(3)МзЭЌбЇдкЪЕбщЪвжагУШчЭМзАжУжЦБИCO2ЦјЬхЃЌВЂЭЈШыТЫвКBжажЦБИAl(OH)3ЪБЃЌНсЙћУЛгаВњЩњдЄЦкЯжЯѓЁЃ
ввЭЌбЇЗжЮіШЯЮЊЃКМзЭЌбЇЭЈШыCO2ЕФСПВЛзуЪЧЕМжТЪЕбщЪЇАмЕФдвђжЎвЛЃЌФуШЯЮЊввЕФЗжЮіЪЧЗёКЯРэЃП________ЁЃШєКЯРэЃЌЧыгУРызгЗНГЬЪННтЪЭЦфдвђ_________________________________(ШєФуШЯЮЊВЛКЯРэЃЌИУПеВЛзїД№)ЁЃ

II.ФГЪЕбщаЁзщЮЊЬНОПClOЃЁЂI2ЁЂSO42-дкЫсадЬѕМўЯТЕФбѕЛЏадЧПШѕЃЌЩшМЦЪЕбщШчЯТЃК
ЪЕбщЂйЃКдкЕэЗлЕтЛЏМиШмвКжаМгШыЩйСПДЮТШЫсФЦШмвКЃЌВЂМгШыЩйСПЕФЯЁСђЫсЃЌШмвКСЂМДБфРЖЃЛ
ЪЕбщЂкЃКЯђЪЕбщЂйЕФШмвКжаМгШы4 mL 0.5 molЁЄLЃ1ЕФбЧСђЫсФЦШмвКЃЌРЖЩЋЧЁКУЭъШЋЭЪШЅЁЃ
(1)аДГіЪЕбщЂйжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЃК_____________________________
(2)ЪЕбщЂкЕФЛЏбЇЗДгІжазЊвЦЕчзгЕФЮяжЪЕФСПЪЧ_______________________ЁЃ
(3)вдЩЯЪЕбщЫЕУїЃЌдкЫсадЬѕМўЯТClOЃЁЂI2ЁЂSO42-ЕФбѕЛЏадгЩШѕЕНЧПЕФЫГађЪЧ__________________________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГбаОПаЁзщгУNaOHШмвКЮќЪеЮВЦјжаЕФH2SЦјЬхЃЌдйНЋЕУЕНЕФNa2SШмвКНјааЕчНтжЦЕУNaOHШмвКЃЌвдЪЕЯжNaOHЕФбЛЗРћгУЁЃЕчНтзАжУШчЭМЫљЪОЃЌЕчМЋВФСЯОљЮЊЪЏФЋЃЌabЁЂcdОљЮЊРызгНЛЛЛФЄЁЃЯТСаа№ЪіВЛе§ШЗЕФЪЧ
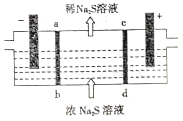
A. ab БэЪОбєРызгНЛЛЛФЄЃЌcd БэЪОвѕРызгНЛЛЛФЄ
B. вѕМЋЕФЕчМЋЗДгІЪНЮЊ2H2O-4e-==O2Ёќ+4H+ЃЌвѕМЋЧјШмвКpHНЕЕЭ
C. бєМЋЕФЕчМЋЗДгІЪНЮЊS2--2e-==SЁ§ЃЌбєМЋЧјгаЕЛЦЩЋГСЕэВњЩњ
D. ЕБЕчТЗжазЊвЦ1molЕчзгЪБЃЌЛсга11.2 L (БъзМзДПі)ЕФЦјЬхЩњГЩ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЪЕбщаЁзщЭЌбЇЮЊСЫЬНОПЭгыХЈСђЫсЕФЗДгІЃЌНјааСЫШчЯТЪЕбщЃЌЪЕбщзАжУШчЭМЫљЪОЁЃ
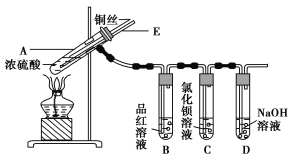
ЪЕбщВНжшЃК
ЂйЯШСЌНгШчЭМЫљЪОЕФзАжУЃЌМьВщКУЦјУмадЃЌдйМгШыЪдМСЃЛ
ЂкМгШШAЪдЙмЃЌД§BЪдЙмжаЦЗКьШмвКЭЫЩЋКѓЃЌЯЈУ№ОЦОЋЕЦЃЛ
ЂлНЋCuЫПЯђЩЯГщЖЏРыПЊвКУцЁЃ
ЧыЛиД№ЯТСаЮЪЬтЃК
(1)AЪдЙмжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ____________________________________________ЁЃ
(2)ФмЙЛжЄУїЭгыХЈСђЫсЗДгІЩњГЩЦјЬхЕФЪЕбщЯжЯѓЪЧ_______________________________ЁЃ
(3)дкЪЂгаBaCl2ШмвКЕФCЪдЙмжаЃЌГ§СЫЕМЙмПкгаЦјХнЭтЃЌЮоЦфЫћУїЯдЯжЯѓЃЌШєНЋЦфжаЕФШмвКЗжГЩСНЗнЃЌЗжБ№ЕЮМгЯТСаШмвКЃЌНЋВњЩњГСЕэЕФЛЏбЇЪНЬюШыБэжаЖдгІЕФЮЛжУЁЃ
ЕЮМгЕФШмвК | ТШЫЎ | АБЫЎ |
ГСЕэЕФЛЏбЇЪН | ________ | ________ |
аДГіЦфSO2БэЯжЛЙдадЕФРызгЗДгІЗНГЬЪНЃК______________________________________ЁЃ
(4) зАжУDЕФзїгУ__________________________________________________________ ЁЃ
(5)ЪЕбщЭъБЯКѓЃЌЯШЯЈУ№ОЦОЋЕЦЃЌгЩгкЕМЙмEЕФДцдкЃЌЪдЙмBжаЕФвКЬхВЛЛсЕЙЮќШыЪдЙмAжаЃЌЦфдвђЪЧ_________________________________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШ§ЗњЛЏЕЊ(NF3)(ЗњжЛгаСНжжМлЬЌЃКЃ1ЃЌ0)ЪЧЮЂЕчзгЙЄвЕжагХСМЕФЕШРызгПЬЪДЦјЬхЃЌЫќдкГБЪЊЕФЛЗОГжаФмЗЂЩњЗДгІ:3NF3+5H2O![]() 2NO+HNO3+9HFЁЃЯТСагаЙиИУЗДгІЕФЫЕЗЈе§ШЗЕФЪЧ( )
2NO+HNO3+9HFЁЃЯТСагаЙиИУЗДгІЕФЫЕЗЈе§ШЗЕФЪЧ( )
A. NF3ЪЧбѕЛЏМСЃЌH2OЪЧЛЙдМС
B. Шє1mol NF3БЛбѕЛЏЃЌЗДгІзЊвЦЕчзгЪ§ЮЊ2NA
C. ШєЩњГЩ0.4molHNO3ЃЌдђзЊвЦ0.4molЕчзг
D. бѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ1ЁУ2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђКЌH2SЁЂFe2ЃЋЁЂBrЃЁЂIЃИї0.1 molЕФШмвКжаЭЈШыCl2 ЃЌЭЈШыCl2ЕФЬхЛ§(БъзМзДПі)КЭШмвКжаЯрЙиРызгЕФЮяжЪЕФСПЙиЯЕЭМе§ШЗЕФЪЧЃЈ ЃЉ
A. 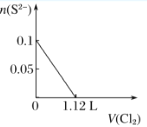 B.
B. 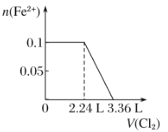 C.
C. 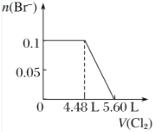 D.
D. 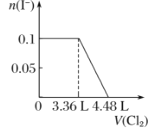
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдгкФГаЉРызгЕФМьбщМАНсТлвЛЖЈе§ШЗЕФЪЧ
A. МгШыЯЁбЮЫсВњЩњЮоЩЋЦјЬхЃЌНЋЦјЬхЭЈШыГЮЧхЪЏЛвЫЎжаЃЌШмвКБфЛызЧЃЌвЛЖЈгаCO![]()
B. МгШыТШЛЏБЕШмвКгаАзЩЋГСЕэВњЩњЃЌдйМгбЮЫсЃЌГСЕэВЛЯћЪЇЃЌвЛЖЈгаSO![]()
C. МгШыЧтбѕЛЏФЦШмвКВЂМгШШЃЌВњЩњЕФЦјЬхФмЪЙЪЊШѓЕФКьЩЋЪЏШяЪджНБфРЖЃЌвЛЖЈгаNH![]()
D. МгШыЬМЫсФЦШмвКВњЩњАзЩЋГСЕэЃЌдйМгбЮЫсАзЩЋГСЕэЯћЪЇЃЌвЛЖЈгаBa2ЃЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. ЭЌвЛдЊЫиИїКЫЫиЕФжЪСПЪ§ВЛЭЌЃЌЕЋЫќУЧЕФЛЏбЇаджЪМИКѕЭъШЋЯрЭЌ
B. ШЮКЮдЊЫиЕФдзгЖМЪЧгЩКЫЭтЕчзгКЭКЫФкжазгЁЂжЪзгЙЙГЩЕФ
C. ФЦдзгЪЇШЅвЛИіЕчзгКѓБфГЩСЫФЪдзг
D. ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЕФжЪСПЪ§ЯрЭЌЃЌЫљвдЫќУЧЛЅЮЊЭЌЮЛЫи
ЕФжЪСПЪ§ЯрЭЌЃЌЫљвдЫќУЧЛЅЮЊЭЌЮЛЫи
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУЯТСазАжУЭъГЩЯрЙиЪЕбщЃЌВЛКЯРэЕФЪЧЃЈЁЁЁЁЃЉ
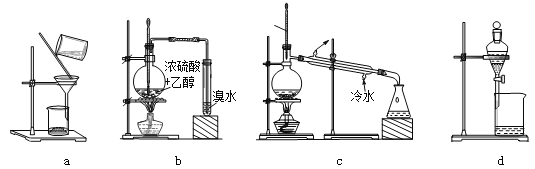
A. гУaГУШШЙ§ТЫЬсДПБНМзЫсB. гУbжЦБИВЂМьбщввЯЉ
C. гУcГ§ШЅфхБНжаЕФБНD. гУdЗжРыЯѕЛљБНгыЫЎ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com