
【题目】I.某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:

(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:烧杯、托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是______________。
(2)写出步骤①中发生反应的离子方程式___________
(3)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?________。若合理,请用离子方程式解释其原因_________________________________(若你认为不合理,该空不作答)。

II.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:_____________________________
(2)实验②的化学反应中转移电子的物质的量是_______________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是__________________________________________________________。
【答案】500mL容量瓶;Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O合理CO2+2OH-=CO32-+H2O2I-+ClO-+2H+=Cl-+I2+H2O4×10-3molClO->I2>SO42-
【解析】
I.(1)根据本实验的目的,实验室配制一定物质的量浓度的溶液中需要的仪器是烧杯、托盘天平、500mL容量瓶、药匙、玻璃棒、胶头滴管,因此缺少的仪器是500mL容量瓶;(2)Al2O3属于两性氧化物,Fe2O3属于碱性氧化物,SiO2属于酸性氧化物,SiO2不与盐酸反应,因此反应①中的离子反应方程式为Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O;(3)滤液B中有过量NaOH溶液存在,通入CO2气体,CO2先于NaOH反应,如果CO2少量,发生CO2+2OH-=CO32-+H2O,,因此该同学分析合理;II.(1)溶液变蓝,说明有I2的生成,利用ClO-的氧化性,把I-氧化成I2,其离子方程式为2I-+ClO-+2H+=Cl-+I2+H2O;(2)蓝色褪去,说明I2与Na2SO3发生氧化还原反应,SO32-被氧化成SO42-,即转移电子物质的量为4×10-3×0.5×(6-4)mol=4×10-3mol;(3)根据氧化还原反应的规律,①反应中ClO-为氧化剂,I2为氧化产物,即ClO-氧化性强于I2,②中I2为氧化剂,SO42-为氧化产物,即I2的氧化性强于SO42-,综上所述,氧化性:ClO->I2>SO42-。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.欲配制0.18 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案;
方案一:用托盘天平称取________g无水醋酸钠,溶于适量水中,配成500 mL溶液。定容时若仰视容量瓶刻度线,则所配制结果将___________(填“偏大”“偏小”或“无影响”)。
方案二:用体积均为250 mL且浓度均为________ mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
Ⅱ.某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)写出上述反应的化学方程式______________________________
(2) NaH2PO2 为__________ (填“正盐”或“酸式盐”),
(3)已知NaH2PO2水溶液pH>7,次磷酸的电离方程式为______________________;
NaH2PO2水溶液pH>7的原因:________________________________________。
(4)H3PO2 及 NaH2PO2均可将溶液中的 Ag+ 还原为银,从而可用于化学镀银。
利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4︰1,则氧化产物为:
______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①1 mol羟基所含电子数为10NA;
②一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液中含NH4+的物质的量小于0.5NA;
③1 mol臭氧和1.5 mol氧气含有相同的氧原子数;
④58.5 g的NaCl固体中含有NA个氯化钠分子;
⑤在反应KIO3+6HI==KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA;
⑥标准状况下,2.24 L H2O含有的分子数等于0.1NA;
⑦1 mol 乙烷分子中含有8NA个共价键;
⑧78gNa2O2中含有NA个阴离子;
⑨常温下,7.1 g Cl2与足量NaOH溶液反应转移的电子数约为0.2×6.02×1023;
⑩4.0 g重水(D2O)中所含质子数为2NA。
A. ④⑤⑦⑧⑨ B. ②③⑧⑩ C. 只有③ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学史上每一次重大发现都极大地推进了科学的发展。俄国科学家门捷列夫对化学的突出贡献在于( )
A.发现了元素周期律B.提出了原子分子学说
C.揭示了燃烧的本质D.提取了治疟药物青蒿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.20 mol的N2O4气体充入1 L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间 /(s) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) / mol · L-1 | 0.20 | c1 | 0.10 | c2 | c3 | c4 |
c(NO2) / mol · L-1 | 0.00 | 0.12 | 0.20 | 0.22 | 0.22 | 0.22 |
根据本题内容和表中提供数据填空(c1、c2、c3、c4表示相应的浓度),请回答下列各小题:
(1)该反应化学方程式_________________________; 表中c2____c3(填“<”、“>”或“=”)
(2)c4=_______mol · L-1,在0~20 s内NO2的平均反应速率为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 物质的量是表示物质所含微观粒子多少的一个物理量
B. 物质的量的单位——摩尔,只适用于分子、原子和离子
C. 摩尔只能用来计量纯净物中微观粒子的数目
D. 摩尔不能用来计量混合气体中分子的数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,将n(HA)+n(Aˉ)=0.lmol的HA、NaA混合物溶于水形成1L溶液,溶液中c(HA)、c(Aˉ)与pH的关系如图所示。下列叙述中正确的是
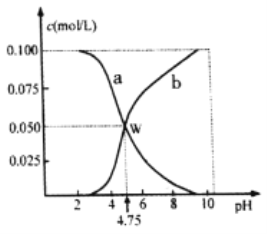
A. a线表示的是c(Aˉ)的变化
B. pH=6 时,c(Na+)+c(HA)>0. 1mol/L
C. 298K时,Aˉ的水解平衡常数(K)的数量级为10-10
D. 若将等物质的量的HA、NaA溶于水中,所得溶液pH恰好为4.75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校购买的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为1.84mol/L
B. 1mol Zn与足量的该硫酸反应产生2gH2
C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基.I可以用E和H在一定条件下合成:
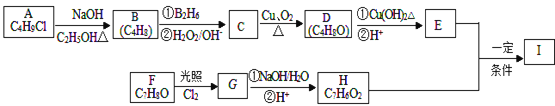
已知以下信息:
①A的核磁共振氢谱表明其只有一种化学环境的氢;
②R﹣CH=CH2![]() R﹣CH2CH2OH;
R﹣CH2CH2OH;
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为___________________________
(2)D的结构简式为__________________________
(3)E中的官能团名称为__________________
(4)F生成G的化学方程式为________________________________________,该反应类型为_____________________________。
(5)I的结构简式为______________________________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,共有____种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com