
【题目】下列实验的反应原理用离子方程式表示正确的是
A.明矾净水:Al3++3H2O=Al(OH)3↓+3H+
B.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2![]() Cu2++2C1-
Cu2++2C1-
D.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】一定条件下, CH4与 H2O(g)发生反应: CH4(g) + H2O(g)=CO(g) + 3H2(g)。设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时 CH4的体积分数 φ(CH4)与Z和 T(温度)的关系如右图所示,下列说法正确的是

A.该反应的焓变△H>0
B.图中 Z 的大小为 a>3>b
C.图中 X 点对应的平衡混合物中 n(H2O)/n(CH4)=3
D.温度不变时,图中 X点对应的平衡在加压后 φ(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素的单质及其化合物在生产生活中应用极其广泛。请完成下列填空:
Ⅰ:氯气性质探究
设计下图实验装置来制备并验证氯气的性质(部分夹持装置未画出)。

(1)A中放置固体二氧化锰的装置名称是___________________。
(2)装置B的作用是___________________。
(3)硬质玻璃管C中事先装有两个沾有相关试剂的棉球,左侧棉球的实验现象为 。
(4)D中的NaOH溶液用来吸收尾气,向反应后的D中加入足量稀硫酸会产生气体,写出该反应的离子方程式 。
Ⅱ:制备HClO
(5)设计装置E代替上图的装置C,用于制备较高浓度的HClO溶液。在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙。

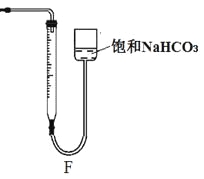
①该方案可以制得较高浓度HClO的原因是(结合必要的化学语言回答) 。
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除HClO外,还含有 、 (写两种钙盐的化学式,一种正盐,一种酸式盐);该小组同学测得反应中碳酸钙质量减少M g,反应后从所得的200mL溶液中取用10mL与足量稀盐酸混合,连接F装置测得产生的气体体积为V L(已换算成标准状况),则原溶液中含钙正盐的浓度为 mol·L-1(用含M、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家近期研究发现,NaHCO3可显著结合癌细胞中乳酸电离出的H+,从而间接地“饿死”癌细胞,下列说法中不正确的是
A. NaHCO3为弱电解质 B. H2CO3的酸性弱于乳酸
C. NaHCO3也可以用来治疗胃酸过多 D. NaHCO3固体中含有离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是( )
A.新制氯水呈黄绿色,且有刺激性气味,说明氯水中含有Cl2
B.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,可说明氯水中含有Cl2
C.向淀粉碘化钾溶液中加入氯水,溶液变成蓝色,说明Cl2可以与盐发生置换反应
D.新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 反应Ⅰ
CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2 =+41.2kJmol-1 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJmol-1 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
(1)研究证实,CO2可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式是_________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)能说明反应Ⅱ已经达到平衡状态的是_____________。
A.混合气体的平均相对分子质量不变
B.混合气体的密度不变
C.v(H2)正>v(CO)正
D.n(CO)/n(H2)不变
(4)在恒容密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。

①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应span>)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。则上述反应压力平衡常数KP为____________(用P0表示,并化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是
A. 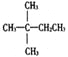 B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com