
【题目】化学实验是研究化学反应的有效方法。
Ⅰ.ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。
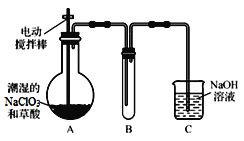
(1)实验时装置A需在60℃~100℃进行的原因是 ,控制所需温度的方法是 。
(2)电动搅拌棒的作用是 。装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为 。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式 。
Ⅱ. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是_______________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:

分析上图能够得出的实验结论是________________________。
【答案】Ⅰ.(1)温度过低,化学反应速率较慢,温度过高草酸升华或分解;(2分)水浴加热(1分)
(2)将反应物充分混合(或充分反应、或使反应物受热均匀)(1分)
2NaClO3+H2C2O4![]() Na2CO3+CO2↑+2ClO2↑+H2O;(2分)
Na2CO3+CO2↑+2ClO2↑+H2O;(2分)
(3)2ClO2+2OH-=ClO3-+ClO2-+H2O(2分)
Ⅱ.(1)探究反应物浓度对化学反应速率的影响(2分)向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(2分)(2)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率(2分)
【解析】
试题分析:Ⅰ.(1)一般来说,升高温度,活化分子的百分数增大,反应速率增大,温度过低,化学反应速率较慢,无水草酸100℃可以升华,温度过高草酸升华或分解,所以实验时装置A需在60℃~100℃进行,反应温度低于水的沸点,用水浴可使反应容器受热均匀,所以反应要用水浴加热;
(2)实验时电动搅拌,能增加反应物的接触机会,将反应物充分混合(或充分反应、或使反应物受热均匀),使反应速率加快,装置A中反应物为NaClO3、H2C2O4,产物有Na2CO3、ClO2和CO2等,Cl(+5→+4),C(+3→+4),根据得失电子守恒和原子守恒,该反应方程式为:2NaClO3 + H2C2O4 ![]() Na2CO3 + CO2↑+ 2ClO2↑+ H2O;
Na2CO3 + CO2↑+ 2ClO2↑+ H2O;
(3)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-,反应的离子方程式为:2ClO2 + 2OH-=ClO3-+ ClO2-+ H2O。
Ⅱ.(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】在250mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。取此溶液20mL,用水稀释至100 mL,稀释后该硫酸盐的物质的量浓度为
A.2 mol·L﹣1 B.0.4 mol·L﹣1 C.0.8 mol·L﹣1 D.1.2mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-有机化学基础】聚合物F的合成路线图如下:
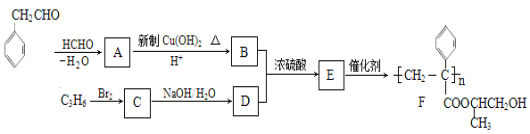
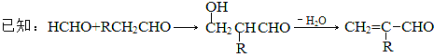
请据此回答:
(1) A中含氧官能团名称是_______,C的系统命名为_________。
(2) 检验B中所含官能团所用的试剂有______;E→F的反应类型是___________。
(3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为___________(同一个碳原子上连两个碳碳双键的除外)。
(4)G物质与![]() 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比![]() 大14的,则符合下列条件的G的同分异构体有__________种。
大14的,则符合下列条件的G的同分异构体有__________种。
① 分子中含有苯环,且苯环上有两个取代基 ② 遇氯化铁溶液变紫色 ③ 能与溴水发生加成反应
(5) 参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 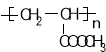 的合成路线 。
的合成路线 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液中,它们的电离平衡常数分别为4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11,其中氢离子浓度最小的是
A.HNO2 B.HCOOH C.HCN D.H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组对乙醇的分子结构进行探究,其过程如下:
猜想一:乙醇的结构简式是CH3CH2OH
猜想二:乙醇的结构简式是CH3OCH3
制定方案并实施:按下图所示实验装置进行实验,

测定乙醇与钠反应(放热)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。
试回答下列问题:
(1)指出实验装置中的错误 。
(2)如果实验装置和操作正确,且结论符合猜想一,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为 。
(3)如果实验装置和操作正确,且结论符合猜想二,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为 。
(4)如果实验装置正确,实验结果为2.3 g乙醇与足量金属钠反应时产生了标准状况下的氢气约0.56 L,则乙醇的结构简式应为 ,理由是 。
(5)该实验获得成功的关键,除了需要纠正图中的装置错误以外,还需注意下列问题中的 (用序号填写)。
①装置的气密性良好;
②实验开始前准确测定乙醇的量;
③钠足量;
④广口瓶中水的体积大于560 mL;
⑤氢气的体积测算准确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3和CO等物质。
(1)烟气的脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点。
选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=﹣905.5kJ/mol
N2(g)+O2(g)=2NO(g) △H= +180kJ/mol
则4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H=
②在催化剂作用下,尿素[CO(NH2)2]也可以将NOx反应生成N2和H2O。写出CO(NH2)2与NO2反应的化学方程式 。
(2)电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应是 。
(3)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(4)废水中含氮化合物的处理方法有多种。
①用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是__________。
②用H2催化还原法可降低水中NO![]() 的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:FeS2中S为-1价,Cu2S中S为-2价。对于反应l4CuSO4+5FeS2+12H2O =7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.只有硫酸铜作氧化剂
B.SO42-既不是氧化产物又不是还原产物
C.被氧化的硫与被还原的硫的质量比为3:7
D.1 mol硫酸铜可以氧化5/7 mol的硫原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】树德中学高2016级研宄性学习小组请你参与“研究铁与水反应所得固体物质的成分,性质及再利用”实验探宄,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验

(1)硬质玻璃管中发生反应的化学方程式为__________________。
(2)反应前A中投放碎瓷片的日的是__________________。
(3)装置E中的现象是__________________。
探究二 设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)硬质玻璃管B冷却后,取少许其中的固体物质溶于后,将所得溶液分成两份。
(5)一份滴加儿滴KSCN溶液。若溶液变m红色,推断硬质玻璃管B中固体物质的成分为______________(选填序号,①一定有Fe3O4 ②一定有Fe ③只有Fe3O4④只有Fe,下同);若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为______________。
(6)另—份用胶头滴管加入_______________,若出现______________现象,可以证明溶液中存在Fe2+,其反应的离子方程式是_____________。
探究三 设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。

(7)试剂b的化学式是_________。
(8)计算反应后B装置中铁元素的质量分数为_______________。(保留小数点后—位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关“电离平衡”的叙述正确的是( )
A. 电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等
B. 电离平衡时,由于分子和离子的浓度不再发生变化,所以说电离平衡是静态平衡
C. 弱电解质达到电离平衡后,各种离子的浓度一定相等
D.电离平衡是相对的、暂时的、外界条件改变时,平衡就会发生移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com