
����Ŀ�������������۵���Ҫ��Ⱦ��ΪPM10��PM2.5��SO2��NO2��O3��CO��������
��1����������������NOx������������SO2���������ǻ�����ѧ�о����ȵ㡣
ѡ���Դ���ԭ������SCR����Ŀǰ�����������������������ڴ��������£��û�ԭ������NH3��ѡ���Ե���NOx��Ӧ����N2��H2O��
����֪��4NH3��g��+5O2��g��=4NO��g��+6H2O��g�� ��H=��905.5kJ/mol
N2��g��+O2��g��=2NO��g�� ��H= +180kJ/mol
��4NH3��g��+4NO��g��+O2��g��=4N2��g��+6H2O��g�� ��H=
���ڴ��������£�����[CO��NH2��2]Ҳ���Խ�NOx��Ӧ����N2��H2O��д��CO��NH2��2��NO2��Ӧ�Ļ�ѧ����ʽ ��
��2���绯ѧ���Ǻϳɰ���һ���·�������ԭ����ͼ1��ʾ�������ĵ缫��Ӧ�� ��
��3����̼��[n(NH3)/n(CO2)]�Ժϳ�����[2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)]��Ӱ�죬���º���ʱ���������ʵ���3 mol��NH3��CO2�Բ�ͬ�İ�̼�Ƚ��з�Ӧ�������ͼ2��ʾ��a��b�߷ֱ��ʾCO2��NH3��ת���ʱ仯��c�߱�ʾƽ����ϵ�����ص���������仯��[n(NH3)/ n(CO2)]= ʱ�����ز���������㣬ͼ��y= (��ȷ��0.01)��
CO(NH2)2(g)+H2O(g)]��Ӱ�죬���º���ʱ���������ʵ���3 mol��NH3��CO2�Բ�ͬ�İ�̼�Ƚ��з�Ӧ�������ͼ2��ʾ��a��b�߷ֱ��ʾCO2��NH3��ת���ʱ仯��c�߱�ʾƽ����ϵ�����ص���������仯��[n(NH3)/ n(CO2)]= ʱ�����ز���������㣬ͼ��y= (��ȷ��0.01)��
��4����ˮ�к���������Ĵ��������ж��֡�
���ô��������������������Եõ�N2H4��ϡ��Һ���÷�Ӧ�Ļ�ѧ����ʽ��__________��
����H2����ԭ���ɽ���ˮ��NO![]() ��Ũ�ȣ��õ��IJ����ܲ������ѭ������Ӧ����Һ��pH (����ߡ��������͡����䡱)��
��Ũ�ȣ��õ��IJ����ܲ������ѭ������Ӧ����Һ��pH (����ߡ��������͡����䡱)��
���𰸡���1������1625.5kJ/mol��2����
��4CO(NH2)2+6NO2��7N2+4CO2+8H2O��2����
��2��N2+6H++6e-��2NH3��2����
��3��2��0.36��ÿ��2����
��4����NaClO+2NH3�TNaCl+N2H4+H2O��2�֣���������2�֣�
��������
�����������1������֪����4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=��905.5kJ/mol
��N2��g��+O2��g��=2NO��g����H=+180kJ/mol�����ݸ�˹���ɿ�֪�����ڡ�4���õ�
4NH3��g��+4NO��g��+O2��g��=4N2��g��+6H2O��g����H=��1625.5kJ/mol��
���ڴ�����������CO��NH2��2��NO2��Ӧ�Ļ�ѧ����ʽΪ4CO(NH2)2 + 6NO2 ��7N2 + 4CO2 + 8H2O��
��2������ͼ1��ʾ��֪��������������������õ�����ת��Ϊ�������������ĵ缫��Ӧ��N2 + 6H+ + 6e- ��2NH3��
��3����ͼ��֪��������Ϊn��NH3��/n��CO2��=2ʱ�����ص�������������y�㰱����ת����Ϊ80%����
2NH3��g��+CO2��g��=CO��NH2��2��g��+H2O��g��
��ʼŨ�ȣ�mol/L �� 2 1 0 0
�仯Ũ�ȣ�mol/L�� 1.6 0.8 0.8 0.8
ƽ��Ũ�ȣ�mol/L�� 0.4 0.2 0.8 0.8
ƽ��CO��NH2��2���������y=0.8/(0.4+0.2+0.8+0.8)=0.36��
��4�����ô��������������������Եõ�N2H4��ϡ��Һ������ԭ���غ�͵��ӵ�ʧ�غ��֪��Ӧ�л����Ȼ��ƺ�ˮ���ɣ��÷�Ӧ�Ļ�ѧ����ʽ��NaClO + 2NH3 �T NaCl + N2H4+ H2O��
��H2����ԭ����ˮ����������ӣ���Ӧ�еĻ�ԭ���������������ɲ������ѭ���������Ϊˮ�͵������÷�ӦΪ5H2+2NO3-![]() N2+4H2O+2OH-������������Ũ��������pH���ߡ�
N2+4H2O+2OH-������������Ũ��������pH���ߡ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������д����л�ѧ����ѧ����������Ĺؼ������б����������
A. �����ŷŵ�β���Ͷ���ȡů�ŷŵĿ�����Ⱦ�����γ�������һ������
B. ��ĭ��������õ���С�մ��������
C. �û���̿Ϊ�ǽ���ɫ���ó���Ư��ֽ������������ԭ����ͬ
D. �Ӻ�ˮ�п���ȡþ����������Ȼ�þ���Ƶý���þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һʱ����������������ڵ����ʣ����в���Ϊ����������ˮ�����
A��FeSO4(Fe) B��SnCl2(HCl) C��FeCl3(HCl) D��NaAlO2(NaOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԳ��л�ѧ֪ʶ���ܽᣬ�������
A����ѧ������Ӧ���Ͱ������Ϸ�Ӧ���ֽⷴӦ���û���Ӧ���ֽⷴӦ����
B���������Ӫ�����ǵ����ʡ����ࡢ��֬��ά���ء����κ�ˮ
C����ͬ��Ԫ����ɵ�����һ���Ǵ�����
D����������ʱ����ʪë����ס�ڱǣ�������������ֳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʵ�����о���ѧ��Ӧ����Ч������
��.ClO2������һ�ָ�Ч�����ס���ȫ��ɱ��������������NaClO3�Ͳ��ᣨH2C2O4����Ӧ�Ƶá���ˮ����100������������ijѧϰС������ͼװ��ģ�ҵ��ȡ�ռ�ClO2 ��
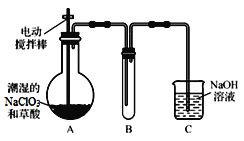
��1��ʵ��ʱװ��A����60��~100�����е�ԭ���� �����������¶ȵķ����� ��
��2���綯������������� ��װ��A�з�Ӧ������Na2CO3��ClO2��CO2�ȣ��÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3����װ��C��ClO2��NaOH��Ӧ���ɵ����ʵ����������Σ�����һ����ΪNaClO2 ��д����Ӧ�����ӷ���ʽ ��
��. ijʵ��С����H2O2�ֽ�Ϊ�����о�Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�졣�ڳ����°������·������ʵ�顣
ʵ���� | ��Ӧ�� | ���� |
�� | 10 mL 2% H2O2��Һ | �� |
�� | 10 mL 5% H2O2��Һ | �� |
�� | 10 mL 5% H2O2��Һ | 1 mL 0.1 mol��L��1 FeCl3��Һ |
�� | 10 mL 5% H2O2��Һ������HCl��Һ | 1 mL 0.1 mol��L��1 FeCl3��Һ |
�� | 10 mL 5% H2O2��Һ������NaOH��Һ | 1 mL 0.1 mol��L��1 FeCl3��Һ |
(1)ʵ��ٺ͢ڵ�Ŀ����_______________________��ʵ��ʱ����û�й۲쵽������������ó����ۡ�������ʾ��ͨ��������H2O2�ȶ������ֽ⡣Ϊ�˴ﵽʵ��Ŀ�ģ����ԭʵ�鷽���ĸĽ���______________________��
(2)ʵ��ۡ��ܡ����У�������������������ʱ��仯�Ĺ�ϵ����ͼ��

������ͼ�ܹ��ó���ʵ�������________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
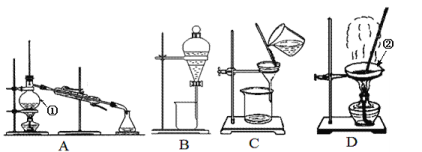
��1��װ��A����������������_____________��װ��D����������������_____________��
��2�����Ȼ�����Һ�еõ��Ȼ��ع���,Ӧѡ��װ��___________�������װ��ͼ����ĸ����ͬ�����ӵ�ˮ�з����I2��ѡ��װ��__________����װ�õ���Ҫ����������_________�����뱥��ʳ��ˮ��ɳ�ӵĻ���Ӧѡ��װ��__________���������Ȼ�̼���е�Ϊ76.75�����ͼױ���110.6�����Ļ���Ӧѡ��װ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5�ֵ������ӣ����Ƿֱ���4018����4019����4019��+��4020��2+��4120��������Ԫ�ط���δд����������������Ԫ�ص������У� ��
A.2��
B.3��
C.4��
D.5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ִ����Ѿ������ԡ�������Ⱦ��Ϊ��־�ĵ�������Ⱦ�Σ����²�����������Ⱦ�����
A. ���ʱ����������
B. ʯ�Ļ����ͷŵķ���������
C. ���ְ����ճ�ϼ��ͷŵļ�ȩ��
D. ��Ȼ��ȼ�ղ�����CO2��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A��s��+B��g���T2D��g����H��0���÷�Ӧ�ﵽƽ������������ĸı�������ƽ��������Ӧ�����ƶ����ǣ� ��
A. �����¶Ⱥͼ�Сѹǿ B. �����¶Ⱥͼ�Сѹǿ
C. �����¶Ⱥ�����ѹǿ D. �����¶Ⱥ�����ѹǿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com