
����Ŀ����ͼ��ʾ��װ�ã�C��D��E��F��X��Y���Ƕ��Ե缫������Դ��ͨ�������е����̪��Һ����F�������Ժ�ɫ��������˵������ȷ���� �� �� 
A.��ԴB���Ǹ���
B.�ס���װ�õ�C��D�� E��F�缫���е������ɣ������ʵ���֮��Ϊ1��2��2��2
C.���ñ�װ�ø�ͭ������HӦ����Ag�����Һ��AgNO3��Һ
D.װ�ö���Y���������ɫ���˵���������������������
���𰸡�C
���������⣺A���������̪���Ȼ�����Һʱ�������������ӷŵ磬�������������Լ��ԣ���������������Һ�Ժ�ɫ����F�������Ժ�ɫ������F������������B���Ǹ�������A��ȷ��
B���������ͭ��Һʱ������C����������������D������ͭ������Ȼ�����Һʱ������E����������������F��������������ͨ����ͬ�ĵ���ʱ�������ʵ�����Ϊ1��2��2��2����B��ȷ��
C�����ʱ���Ʋ�������������Ƽ����������������Һ�н��������Ӻ�������������ͬԪ�أ��������ã�����װ�ø�ͭ������GӦ����Ag�����Һѡ��AgNO3��Һ����C����
D�����ع���ʱ����Һ���������������ƶ����������������ƶ���װ�ö��У�X����������Y����������Y���������ɫ���˵���������������������ƶ����ɴ�֤��������������������ɣ���D��ȷ��
��ѡC��


 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ִ���ҵ�����Ȼ���Ϊԭ���Ʊ�������ֹ����������£� ����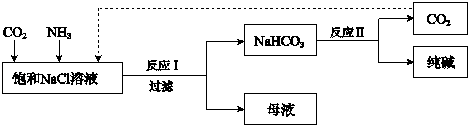
��֪��ӦIΪ��NaCl+CO2+NH3+H2O ![]() NaHCO3��+NH4Cl
NaHCO3��+NH4Cl
��1����ҵ�����У��Ʊ�NH3�Ļ�ѧ����ʽ��
��2����ˮ�к��д�����NaCl���Լ�������Ca2+��Mg2+��SO42�������ӣ� ��Ϊ�õ������ı���NaCl��Һ�����������²������벹ȫ�������裺
a����Ũ����ĺ�ˮ�м������������������Һ���ˣ�
b������Һ�� �� ���ˣ�
c������Һ�� �� ���ˣ�
d������Һ�м���������ϡ���
e���������һ��ʱ�䣬�õ�����NaCl��Һ��
�ڲ���c�з�Ӧ�����ӷ���ʽ�� ��
��3����ӦII�Ļ�ѧ����ʽ�� ��
��4���ƵõĴ����к�������NaCl��ȡ5.5g������Ʒ��������ϡ���ᣬ�õ���״����1120mL CO2 �� ����Ʒ�д��������������%������1λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺϴ�������ҵ���ϡ��������ڱ�����������Լ��Դ�� 
��1��Ϊ����ij�����Ĺ�ҵ��������Ҫ��N2��SO2��NO��CO�������������ɷ֣����������ͼ1���̣�
��֪��NO+NO2+2NaOH=2NaNO2+H2O��
2NO2+2NaOH=NaNO3+NaNO2+H2O��
�ٷ����ijɷ�Ϊ���ѧʽ����
��ͨ��������ܹ�����ԭ���� ��
�����ռ������յ�������Ҫ��
�ܴ�����NH4+��ˮʱ��������Ӧ�����ӷ���ʽΪ
��2��ij��ɫ��ҵ��ˮ�п��ܺ���NH4+��Na+��Al3+��Cu2+��Cl����SO42����CO32���������еļ������ӣ�Ϊȷ����ɷ֣��������ʵ�飺
a��ȡ10mL�÷�ˮ���Թ��У�����������Ba��NO3��2��Һ��ϡ���ᣬ��ַ�Ӧ����˵õ�0.04mol��ɫ����������Һ�м���AgNO3��Һ����������
b����ȡ10mL�÷�ˮ���Թ��У��μ�NaOH��Һ������ɫ���������������ӵ�һ������ʼ�������壬��������ȫ�ܽ⣮��������������ʵ��������NaOH��Һ����ı仯��ϵ��ͼ2��ʾ���������dz�����������ܽ����ʧ��
��������ʵ���ͼ�����ݣ�
�ٸ÷�ˮ��һ�����е��������������ӷ��ţ���
��ʵ��������100mL����Ũ�ȵ�NaOH��Һʱ���õ��IJ����������ձ�������������Ͳ�⣬����Ҫ�����������ƣ���
��ͼ��a= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��Ϊ�ⶨδ֪Ũ�ȵ�������Һ����������ʵ�飺��1.00mL����������Һ����100mLϡH2SO4��Һ����0.14molL-1��NaOH��Һ�ζ�����ϡH2SO4 25.00mL���ζ���ֹʱ����NaOH��Һ15.00mL��
��1����ѧ����0.14molL-1NaOH����Һ�ζ������ʵ��������£�
A.����ʽ�ζ���ȡϡH2SO4 25.00mL��ע����ƿ�У�����ָʾ����
B.�ô��ⶨ����Һ��ϴ��ʽ�ζ���
C.������ˮϴ�ɾ��ζ���
D.ȡ�¼�ʽ�ζ����ñ���NaOH��Һ��ϴ����Һע���ʽ�ζ��̶ܿ���0������2-3cm�����ٰѼ�ʽ�ζ��̶ܹ��ã�����Һ�����̶���0������0���̶�����
E.���ζ����Ƿ�©ˮ
F.��ȡ��ƿ�����ظ�����һ��
G.����ƿ���ڵζ������棬ƿ�µ�һ�Ű�ֽ���ߵα�ҡ����ƿֱ���ζ��յ㣬����
�ζ���Һ�����ڿ̶�
�ٵζ���������ȷ˳���ǣ��������д�� ( )��( )��D��( ) ��A��( ) ��( ) __________
������ȷŨ�ȵ�ϡH2SO4��Һ������ʹ�õ���Ҫ������ ______
�۹۲��ʽ�ζ��ܶ���ʱ�����ζ�ǰ���ӣ��ζ����ӣ������ᵼ�²�õ�ϡH2SO4��ҺŨ�Ȳⶨֵ ______ ��ѡ����ƫ������ƫ����������Ӱ������
�ܼ���������ᣨϡ��ǰ�����ᣩ��Һ�����ʵ���Ũ�ȣ���������С������λ��_____
����֪����CH3COOH 1mol�Ĵ�����Һ��NaOH(aq)��Ӧ����H=-12.1 kJ��mol-1����HCl1mol ��������NaOH(aq)��Ӧ����H=-55.6 kJ��mol-1����CH3COOH��ˮ��Һ�е������H����______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�һ�����ܱ������У�����һ������һ������������̼������ѧ��Ӧ��
C(s��+2NO(g��![]() CO2(g��+N2(g����ƽ��ʱc (NO�����¶�T�Ĺ�ϵ����ͼ��ʾ��������˵����ȷ����
CO2(g��+N2(g����ƽ��ʱc (NO�����¶�T�Ĺ�ϵ����ͼ��ʾ��������˵����ȷ����
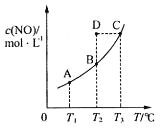
A. �÷�Ӧ����H>0
B. ���÷�Ӧ��T1��T2ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1<K2
C����T2ʱ������Ӧ��ϵ����״̬D�����ʱ![]()
D����״̬B��C��D��ѹǿ�ֱ�ΪPB��PC ��PD ���� PC=PD>PB
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2SO2��g��+O2��g��![]() 2SO3��g����H��0����һ�������´ﵽƽ��״̬��ʱ��Ϊt1ʱ�ı���������ѧ��Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
2SO3��g����H��0����һ�������´ﵽƽ��״̬��ʱ��Ϊt1ʱ�ı���������ѧ��Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ�������

A. ά���¶ȡ��ݻ����䣬t1ʱ����SO3��g��
B. ά��ѹǿ���䣬t1ʱ���߷�Ӧ��ϵ�¶�
C. ά���¶ȡ��ݻ����䣬t1ʱ����һ����Ar
D. ά���¶ȡ�ѹǿ���䣬t1ʱ����SO3��g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ�����ռ����Ҫ��λ��
I.�ϳɰ���ҵ�У���ʼʱ���������������ױ�Ϊ1��3ʱ��ÿ��Ӧ1mol N2���ų�92.2kJ��������ͼΪ�ϳɰ���Ӧ�ڲ�ͬ�¶Ⱥ�ѹǿ��ʹ����ͬ���������£�ƽ�������а������������
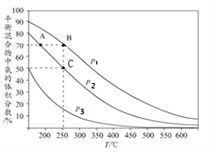
����ͼ��֪��p1��p2��p3�Ĵ�С��ϵΪ________,������_____________________________
��A��B�����ɰ��������ʴ�С��ϵΪ_____________��C�㣬N2��ת����Ϊ_____��
�����й��ںϳɰ���˵����ȷ��_________ (�����)��
A.�Ͽ�1��N��N����ͬʱ��6��N��H���γɣ���Ӧһ���ﵽƽ��״̬
B.��������ƽ����Է����������ٸı�״̬����Ӧһ���ﵽƽ��״̬
C.���ڡ�H<0����S>0���ʺϳɰ���Ӧһ�����Է�����
D.����n(N2):n(H2)�ı�ֵ������������H2��ת����
II.�������Simons�ȿ�ѧ�ҷ����˲���ʹ�����ѻ�Ϊ��Ϳ�ֱ������ȼ�ϵ�صķ��������ط�ӦΪ4NH3+3O2==2N2+6H2O��д�������ĵ缫��Ӧʽ��__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�����ö������棨CeO2����̫���������½�H2O��CO2ת���H2��CO����������£�����˵������ȷ����


A. �ù�����CeO2û������
B. �ù���ʵ����̫������ѧ�ܵ�ת��
C. ��ͼ�С�H1=��H2+��H3
D. ��CO��O2���ɵļ���ȼ�ϵ�صĸ�����ӦʽΪ��CO+4OH��- 2e��=CO32��+2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com