
(9分)氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是 。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该化学方程式是 。
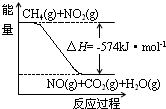
(3)已知:① CH4(g) + 4 NO2(g) = 4 NO(g) + CO2(g) +2 H2O(g) △H= -574 kJ·mol-1
② CH4(g) + 4 NO(g) = 2 N2(g) + CO2(g) + 2 H2O(g) △H= -1160 kJ·mol-1
根据①和②,标准状况下,4.48 L CH4恰好将NO2转化为N2时,△H= 。
由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H -574 kJ·mol-1
(4)同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气完全转化为N2,则原混合
气中 NO和NO2的体积比是 。
(5)含有1mol HNO3的稀硝酸分别与不同质量的铁粉,所得氧化产物a、b与铁粉物质的量关系如下图所示。 b是 n3 = p=

科目:高中化学 来源: 题型:
 氮及其化合物与人们的生活息息相关.
氮及其化合物与人们的生活息息相关.查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)氮及其化合物与人们的生活息息相关。
(1)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。为防止环境污染,可用碱液吸溶液完全吸收后得到一种钠盐收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH,该化学方程式是 。
(2)已知:① CH4(g) + 4 NO2(g) = 4 NO(g) + CO2(g)+2 H2O(g) △H= -574 kJ·mol-1
② CH4(g) + 4 NO(g) =2 N2(g) + CO2(g) + 2 H2O(g) △H= -1160 kJ·mol-1
根据①和②,标准状况下的4.48 L CH4恰好将NO2转化为N2时,△H= 。
(3)同温同压下,3.5 LNH3恰好将3.0 LNO和NO2的混合气完全转化为N2,则原混合气中 NO和NO2的体积比是 。
(4)向含有1mol HNO3的稀硝酸中逐渐加入铁粉,所得氧化产物a、b与铁粉物质的量关系如图所示。n3 = p= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(9分)氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是 。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该化学方程式是 。
(3)已知:① CH4(g)+ 4 NO2(g) = 4 NO(g) + CO2(g) +2 H2O(g) △H= -574 kJ·mol-1
② CH4(g)+ 4 NO(g) = 2 N2(g) + CO2(g) + 2 H2O(g) △H= -1160 kJ·mol-1
根据①和②,标准状况下,4.48 L CH4恰好将NO2转化为N2时,△H= 。
由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H -574 kJ·mol-1
(4)同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气完全转化为N2,则原混合
气中 NO和NO2的体积比是 。
(5)含有1mol HNO3的稀硝酸分别与不同质量的铁粉,所得氧化产物a、b与铁粉物质的量关系如下图所示。 b是 n3 = p=
查看答案和解析>>
科目:高中化学 来源:2012届湖北省襄阳五中高三上学期期中考试化学试卷 题型:填空题
(10分)氮及其化合物与人们的生活息息相关。
(1)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。
(2)已知:① CH4(g) + 4 NO2(g) =" 4" NO(g) + CO2(g) +2 H2O(g) △H=" -574" kJ·mol-1
② CH4(g) + 4 NO(g) =" 2" N2(g) + CO2(g) + 2 H2O(g) △H=" -1160" kJ·mol-1 根据①和②,标准状况下的4.48 L CH4恰好将NO2转化为N2时△H= 。
(3)同温同压下,3.5 L NH3恰好将3.0 LNO和NO2的混合气完全转化为N2,则原混合气中NO和NO2的体积比是 。
(4)向含有1mol HNO3的稀硝酸中逐渐加入铁粉,所得氧化产物a、b与铁粉物质的量关系如图所示,则n3 = p=  。
。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省襄阳市四校高三上学期期中联考化学试卷 题型:填空题
(12分)氮及其化合物与人们的生活息息相关。
(1)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。为防止环境污染,可用碱液吸溶液完全吸收后得到一种钠盐收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH,该化学方程式是 。
(2)已知:① CH4(g) + 4 NO2(g) = 4 NO(g) + CO2(g) +2 H2O(g) △H= -574 kJ·mol-1
② CH4(g) + 4 NO(g) = 2 N2(g) + CO2(g) + 2 H2O(g) △H= -1160 kJ·mol-1
根据①和②,标准状况下的4.48 L CH4恰好将NO2转化为N2时,△H= 。
(3)同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气完全转化为N2,则原混合气中 NO和NO2的体积比是 。
(4)向含有1mol HNO3的稀硝酸中逐渐加入铁粉,所得氧化产物a、b与铁粉物质的量关系如图所示。n3 = p= 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com