
【题目】利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) /×10-3 mol·L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO) / ×10-3 mol·L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
下列说法中,不正确的是
A.2s内的平均反应速率υ(N2)=1.875×10-4 mol·L-1·s-1
B.在该温度下,反应的平衡常数K=5
C.若将容积缩小为原来的一半,NO转化率大于90%
D.使用催化剂可以通过提高活化分子百分数提高单位时间CO和NO的处理量
【答案】B
【解析】
试题分析:A.2s内△c(NO)=(1-0.25)×10-3 molL-1=7.5×10-4 molL-1,则△c(N2)=![]() △c(NO)=3.75×10-4 molL-1,则v(N2)=
△c(NO)=3.75×10-4 molL-1,则v(N2)=![]() =1.875×10-4molL-1s-1,故A正确;B.4s时处于平衡状态,平衡时NO为1.0×10-3 molL-1,则:
=1.875×10-4molL-1s-1,故A正确;B.4s时处于平衡状态,平衡时NO为1.0×10-3 molL-1,则:
2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始量(×10-3 molL-1):1 3.6 0 0
变化量(×10-3 molL-1):0.9 0.9 0.9 0.45
平衡量(×10-3 molL-1):0.1 2.7 0.9 0.45
则平衡常数K=![]() =
=![]() =5000,故B错误;C.原平衡时NO转化率为
=5000,故B错误;C.原平衡时NO转化率为![]() =90%,若将容积缩小为原来的一半,增大压强,平衡正向移动,NO转化率增大,故新平衡时NO转化率大于90%,故C正确;D.使用催化剂加快反应速率,可以提高单位时间CO和NO的处理量,故D正确,故选B。
=90%,若将容积缩小为原来的一半,增大压强,平衡正向移动,NO转化率增大,故新平衡时NO转化率大于90%,故C正确;D.使用催化剂加快反应速率,可以提高单位时间CO和NO的处理量,故D正确,故选B。


科目:高中化学 来源: 题型:
【题目】用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(l) ΔH1
5N2(g)+6H2O(l) ΔH1
反应II: 2NO(g)+O2(g) ![]() 2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
反应III:4NH3(g)+6NO2(g) ![]() 5N2(g)+3O2(g)+6H2O(l) ΔH3
5N2(g)+3O2(g)+6H2O(l) ΔH3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)ΔH3=____________(用ΔH1、ΔH2的代数式表示);推测反应III是________反应(填“吸热”或“放热”)。
(2)相同条件下,反应I在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=______________。
②下列说法不正确的是_______。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如右。溶液中OH向电极____移动(填a或b),负极的电极反应式为________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(已知硅与稀硫酸不反应),测定通常状况(20℃,101 kPa)下的气体摩尔体积。拟选用下列实验装置完成实验:

(1)该小组同学必须选用的装置依次连接的合理顺序为A、_____________。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,开始时稀硫酸能滴人锥形瓶中,一段时间后稀硫酸不能顺利滴入锥形瓶中,其原因是____________________。
(3)金属铝与稀硫酸反应的离子方程式为_________________。
(4)实验结束时,测量实验中生成H2体积的操作方法是_______________。
(5)实验中准确测得3个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验后量筒中液面读数为V ml。。则通常状况下气体摩尔体积Vm=__________L·mol-l。若合金中含少量铜,则所测得的Vm将____________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成。甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子。A元素原子核内质子数比E的少l,D、E同主族。某同学为探究甲的组成而进行如下实验:

①取mg甲的晶体溶于蒸馏水,配成500 mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;
③取20 mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224 mL。
回答下列问题:
(1)D在元素周期表中的位置为_ 。
(2)经测定晶体甲的摩尔质量为453 g·mol-1,其中阳离子和阴离子物质的量之比为1:1。 则晶体甲的化学式为 。
(3)图像中V(Oa):V(ab):V(bc)= 。
(4)写出ab段发生反应的离子方程式: 。
(5)配成的甲溶液物质的量浓度是_ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的Cl-扩散到孔口,并与各电极产物作用生成多孔粉状锈Cu2(OH)3Cl下列说法不正确的是
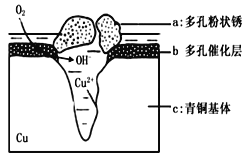
A.腐蚀过程中,负极c被氧化
B.环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
C.若生成 2.145gCu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448L
D.正极的电极反应式为:正极反应是 O2+ 4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 用肼(N2H4)还原新制Cu(OH)2 |
方法Ⅲ | 电解法:2Cu+H2O |
已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=-akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H=-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H=-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H = kJ·mol-1
(1)工业上很少用方法Ⅰ制取Cu2O是由于方法Ⅰ反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: 。
(2)方法Ⅱ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式:阴极 ;阳极 。

(4)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+ O2(g) ⊿H >0,水蒸气的浓度(mol·L-1)随时间t (min)变化如下表所示:
2H2(g)+ O2(g) ⊿H >0,水蒸气的浓度(mol·L-1)随时间t (min)变化如下表所示:
序号 | Cu2Oa克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法Ⅱ | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 方法Ⅱ | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | 方法Ⅲ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号)。
a.实验的温度T2小于T1
b.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
c.实验②比实验①所用的催化剂催化效率高
d.实验①、②、③的化学平衡常数的关系:K1=K2<K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻轨电车是近年来城市发展的一种无污染的新兴交通工具,当轻轨电车开动时,轻轨电车与架空电线的接触点由于高速摩擦会产生高温,因此接触点上的材料应该具有现耐高温,不易氧化,能导电的性质,你认为接触点上的材料应选用
A. 金刚石 B. 铝 C. 石墨 D. 铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中含有右表离子中的某5种,且其浓度均为0.1mol/L(不考虑水的电离与离子水解)。向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化。下列叙述不正确的是( )

A.X溶液中不可能含有HC03-或CO32-
B.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+=3Fe3++NO+2H2O
C.根据电荷守恒,原溶液中一定含Mg2+
D.X溶液中一定含3种阳离子、2种阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH = a kJ/mol
COCl2(g) ΔH = a kJ/mol
反应过程中测定的部分数据如下表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
(1)比较各时段平均速率v(COCl2):
v(0-1) _________v(0-2);v(0-2) _________v(1-2) (填“>”、“=”或“<”)。
(2)在2min~4min间,v(Cl2)正_____________v(Cl2)逆 (填“>”、“=”或“<”),该温度下K =____________
(3)已知X、L可分别代表温度或压强,如图表示L一定时,CO的砖化率随X的变化关系。
X代表的物理量是_____________;a____________0(填“>”,“=”,“<”),依据是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com