(2013?德州模拟)Ⅰ.工业上用电解熔融氧化铝的方法来制取金属铝.纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na
3AlF
6)在1000℃左右就可以得到熔融体.
图1是电解槽的示意图.
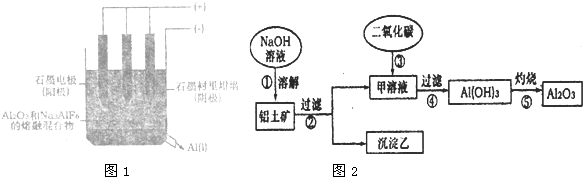
(1)写出电解时阴扳的电极反应式
Al3++3e-=Al
Al3++3e-=Al
.
(2)电解过程中生成的氧气全部与石墨电极反应生成C0和C0
2气体.因此,需要不断补充石墨电极.工业生产中,每生产9t铝阳极损失5.4t石墨.生成的二氧化碳的物质的量为
5×104
5×104
Ⅱ.工业上用铝土矿(主要成分是Al
2O
3,还含有Fe
20
3、Si0
2)提取氧化铝做冶炼铝的原料.其中一种提取的搡作过程如(图2):
请回答下列问题:
(1)请写出甲溶液中通入足量二氧化碳生成氢氧化铝的离子方程式
AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
.
(2)沉淀乙是Fe
20
3和Si0
2的混合物,向其中加入足置盐酸,写出反应的离子方程式
Fe2O3+6H+═2Fe3++3H2O
Fe2O3+6H+═2Fe3++3H2O
,充分反应后过滤,将滤液加热蒸干灼烧,最后可得到红褐色固体,用简要的文字和化学方程式说明这一变化过程
FeCl3+3H2O?Fe(OH)3+3HCl,加热促进水解,且盐酸易挥发,化学平衡正向移动,生成氢氧化铁,最后灼烧氢氧化铁分解生成氧化铁,2Fe(OH)3═Fe2O3+3H2O
FeCl3+3H2O?Fe(OH)3+3HCl,加热促进水解,且盐酸易挥发,化学平衡正向移动,生成氢氧化铁,最后灼烧氢氧化铁分解生成氧化铁,2Fe(OH)3═Fe2O3+3H2O
.
(3)上述提取氧化铝的方法叫碱溶法.工业生产中还有一种酸溶法.
第一步:向铝土矿中加盐酸,然后过滤;第二步:处理得到的滤液.请你思考第二步操作中使用的化学试剂是
NaOH溶液或强碱溶液
NaOH溶液或强碱溶液
.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
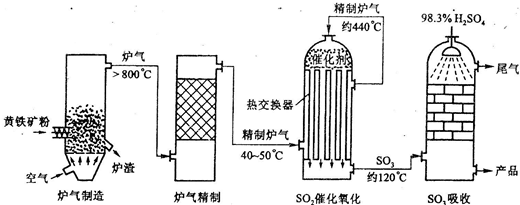
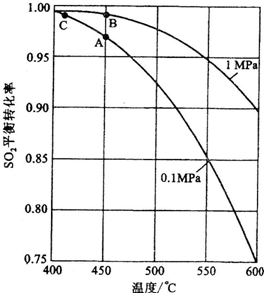
小学生10分钟应用题系列答案 (2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.