
| A. | CH2=CHCH(Br)CH2Br | B. | CH2=CH(Br)CHCH2Br | C. | CH2=CH2CH2CHBr2 | D. | CH Br2CH=CHCH3 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | -1940 kJ•mol-1 | B. | 1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | 485 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖与稀硫酸共热后的溶液中,滴加银氨溶液,验证产物中的葡萄糖 | |
| B. | 淀粉中加入98%的硫酸溶液,在酒精灯上加热,使其水解 | |
| C. | 棉花中加入90%的硫酸,并用玻璃棒把棉花捣烂,在酒精灯上直接加热使其水解 | |
| D. | 向淀粉水解后的溶液中加入碘水,溶液变蓝,证明淀粉尚未水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验做参照 | 0.5 | 2.0 | 90.0 |
| ② | 探究醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
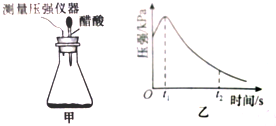 (1)上表中编号②实验中铁粉的质量为2.0g;编号③试验的实验目的是探究碳粉的质量对化学反应速率的影响
(1)上表中编号②实验中铁粉的质量为2.0g;编号③试验的实验目的是探究碳粉的质量对化学反应速率的影响查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②① | B. | ①④②③ | C. | ③①④② | D. | ①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
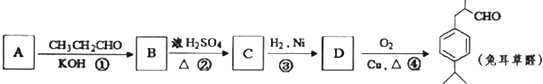
 可写成
可写成
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
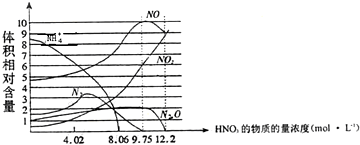
| A. | 一般来说,硝酸与铁反应的还原产物不是单一的 | |
| B. | 用一定量的铁粉与大量的9.75mol•L-1HNO3溶液反应得到标态下气体2.24L,则参加反应的硝酸的物质的量为0.1mol. | |
| C. | 硝酸的浓度越大,其还原产物中价态越高的成份越多 | |
| D. | 当硝酸浓度为9.75mol•L-1时还原产物是NO、NO2、N2O,且其物质的量之比为5:3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com