
分析 铜和浓硫酸的反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
(1)在Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,失电子被氧化,S元素化合价降低,得电子被还原;铜失电子数=1(2-0)=2,硫酸得电子数=1(6-4)=2,该反应中转移电子数是2,据此分析;
(2)被还原的硫酸的物质的量等于二氧化硫的物质的量;
(3)根据稀释前后溶质的物质的量不变计算稀释后硫酸铜的浓度.
解答 解:(1)在Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,失电子被氧化,S元素化合价降低,得电子被还原,H2SO4是氧化剂;铜失电子数=1(2-0)=2,硫酸得电子数=1(6-4)=2,该反应中转移电子数是2,用用双线桥标出该反应电子转移的方向和数目为: ;
;
故答案为: ;
;
(2)被还原的硫酸的物质的量等于二氧化硫的物质的量n(H2SO4)=$\frac{4.48L}{22.4L/mol}$=0.2 mol,答:被还原硫酸的物质的量是0.2 mol;
(3)因为n(CuSO4)=n(SO2)溶液稀释前后溶质的物质的量不变,所以c(CuSO4)=$\frac{0.2mol}{0.5L}$=0.4mol/L,
答:硫酸铜的浓度为0.4mol/L.
点评 本题考查了根据方程式进行计算,正确书写方程式是解本题关键,再结合物质之间的关系式进行解答,难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①是电离平衡 ②是水解平衡 | |
| B. | NaHCO3溶液呈碱性是因为①的程度大于② | |
| C. | 加入NaOH固体,①②平衡都向左移动 | |
| D. | 升高温度,①向右移动,②向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,A是双原子分子气态单质,其密度为3.17g/L(标准标况下),B、C、D都是含A元素的化合物,转化关系如图所示:
常温下,A是双原子分子气态单质,其密度为3.17g/L(标准标况下),B、C、D都是含A元素的化合物,转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有不锈钢都只含有金属元素 | B. | 我国流通的硬币材质是金属单质 | ||
| C. | 金属铝可以大量的制造铝制餐具 | D. | 镁合金的硬度和强度均高于纯镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 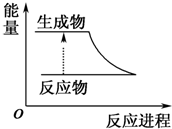 反应过程中的能量变化关系可用如图表示 | |
| B. | CH4的燃烧热是820kJ | |
| C. | 11.2L(标准状况)CH4完全燃烧生成气态水时放出410kJ热量 | |
| D. | 该反应发生断裂的化学键只有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 5种 | C. | 3种 | D. | 8种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com