��2009?�γ�һģ���Ȼ����dz�����ˮ����������ˮFeCl
3���۵�Ϊ555K���е�Ϊ588K����ҵ�ϴ�����ˮFeCl
3��һ�ֹ�����ͼ��ʾ��
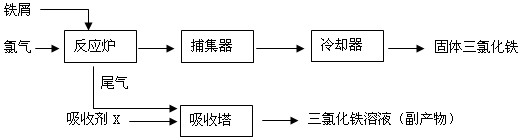
��1��ȡ0.5ml���Ȼ�����Һ����50ml��ˮ�У������Ƭ�̵ú��ɫ��Һ�壬�ù��̿������ӷ���ʽ��ʾΪ��
Fe
3++3H
2O
Fe��OH��
3�����壩+3H
+Fe
3++3H
2O
Fe��OH��
3�����壩+3H
+��
��2����������ˮ���Ȼ�����ˮ�е��ܽ�ȣ�
| �¶�/�� |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| �ܽ��/g |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
��FeCl
3��Һ�л��FeCl
3?6H
2O�ķ����ǣ�
���������������Ũ��������ȴ�ᾧ
���������������Ũ��������ȴ�ᾧ
��
��3�����������¶ȳ���673K��������Է�������Ϊ325�����ʣ������ʵķ���ʽΪ��
Fe2Cl6
Fe2Cl6
��
��4������ʱ��FeCl
3��Һ�еμ�NaOH��Һ������ҺPHΪ2.7ʱ��Fe
3+��ʼ����������ҺPHΪ4ʱ��c��Fe
3+��=
1.1��10-6
1.1��10-6
mol/L����֪��Ksp[Fe��OH��
3]=1.1��10
-36����
��5�����ռ�X��
FeCl2��Һ
FeCl2��Һ
�������������ռ�X��������
���շ�Ӧ¯�й����������������Ȼ�������
���շ�Ӧ¯�й����������������Ȼ�������
��
��6��FeCl
3����������ͨ�����õ������ⶨ����ȡm g��ˮ�Ȼ�����Ʒ������ϡ���ᣬ��ת�Ƶ�100ml����ƿ��������ˮ���ݣ�ȡ��10.00ml�������Թ�����KI��Һ����ַ�Ӧ���õ�����ָʾ������c mol/L Na
2S
2O
3��Һ�ζ���I
2+2S
2O
32-�T2I
-+S
4O
62-��������ȥV ml������Ʒ���Ȼ�������������Ϊ
��




 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�