
【题目】下列有关氧化还原反应的叙述正确的是( )
A.化学反应中电子转移的表示方法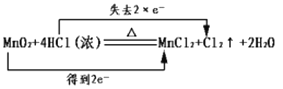
B.离子M2O7x-与S2-能在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3+ +3S +7H2O,则M2O7x-中M的化合价为+7
C.在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O②2A2++B2=2A3++2B-③2B-+Z2 =B2+2Z-根据上述反应,可知道氧化性强弱顺序为:XO4->Z2>B2>A3+
D.已知硝酸铵在一定温度下分解为5NH4NO3=4N2↑+2HNO3+9H2O↑,被氧化的元素和被还原的元素的质量之比为1:1
【答案】AC
【解析】
A. 化学反应中Mn的化合价由+4变为+2价,得2个电子,Cl的化合价由-1变为0价,失去2个电子,则电子转移的表示方法 ,符合题意,A正确;
,符合题意,A正确;
B. 离子M2O7x-与S2-能在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3+ +3S +7H2O,反应中转移6个电子,则M2O7x-中M的化合价为+6,与题意不符,B错误;
C. 氧化性:氧化剂>氧化产物,则在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O,氧化性:XO4-> Z2;②2A2++B2=2A3++2B-氧化性:B2 > A3+;③2B-+Z2 =B2+2Z-氧化性:Z2 > B2;根据上述反应,可知道氧化性强弱顺序为:XO4->Z2>B2>A3+,符合题意,C正确;
D. 已知硝酸铵在一定温度下分解为5NH4NO3=4N2↑+2HNO3+9H2O↑,被氧化的元素和被还原的元素的质量之比为5:3,与题意不符,D错误;
答案为AC。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属Cu。根据流程图,下列说法不正确的是

A.①②操作均为过滤,但D、E溶液成分不完全相同
B.C可以为稀硫酸,也可以是稀盐酸
C.操作③采用冷却结晶,说明硫酸亚铁晶体的溶解度随温度变化有一定变化
D.A为足量铁粉,其反应的离子方程式为:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
填空:(1)以上步骤有错误的是(填编号)_________,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:___________________________________;
(4)如下图是某次滴定时的滴定管中的液面,其读数为_________mL

(5)根据下列数据:请计算待测盐酸溶液的浓度:_______________________mol·L-1
滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO![]() 、NO
、NO![]() 等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
A. Na+、Ba2+、Cl-、SO42— B. MnO4-、K+、I-、H+
C. Ca2+、HCO3—、Cl-、K+ D. H+、Cl-、Na+、CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A.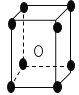 B.
B.
C.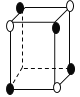 D.
D.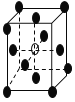
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳气体 ⑥铁 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是___。
(2)属于电解质的是___。
(3)属于非电解质的是____。
(4)⑥和水蒸气反应的化学方程式为___,①与②在溶液中反应使溶液呈中性的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-测定的基本原理是将其氧化成I2,再用Na2S2O3标准溶液来滴定。如果样品中仅含有微量I-,必须用“化学放大”反应将碘的量“放大”,然后再进行测定。下面是化学放大反应的实验步骤:
I.将含有微量I-的样品溶液调至中性或弱酸性,加入溴水,将I-完全氧化成IO![]() ,煮沸去掉过量的溴;
,煮沸去掉过量的溴;
Ⅱ.取上述溶液,加入过量硫酸酸化的KI溶液,振荡,溶液颜色呈棕黄色;
Ⅲ.将Ⅱ所得溶液中全部的I2萃取至CCl4中;
Ⅳ.向分液后的CCl4溶液中加入肼(N2H4)的水溶液,产生无毒的N2,分去有机层;
V.将Ⅳ所得水溶液重复I、Ⅱ步骤;
Ⅵ.以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。已知:反应为:I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() ;Na2S2O3和Na2S4O6溶液颜色均为无色。
;Na2S2O3和Na2S4O6溶液颜色均为无色。
(1)I中氧化剂和还原剂物质的量之比为______。
(2)Ⅲ中使用的主要玻璃仪器是______(填名称)。
(3)Ⅳ中反应的离子方程式是______。
(4)Ⅵ中需要在中性或弱酸性环境中进行,pH过大,Na2S2O3易被I2氧化成Na2SO4,其离子方程式为_______;结合离子方程式解释pH不宜过小的原因:______。VI中滴定终点的现象是______。
(5)样品中I-最终所消耗的Na2S2O3的物质的量与样品中初始I-物质的量的比值称为“放大倍数”。经过以上操作,放大倍数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图)。下列说法正确的是

A. 化合物(A)不能与乙醇发生反应
B. 化合物(B)分子式为C6H6Cl6
C. 化合物(B)可通过苯与Cl2发生加成反应制得
D. 1mol化合物(A)可与3molH2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com