
【题目】向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( ) 
A.原NaOH溶液的浓度为0.1mol/L
B.通入CO2的体积为448mL
C.所得溶液的溶质成分的物质的量之比为(NaOH):(Na2CO3)=1:3
D.所得溶液的溶质成分的物质的量之比为(NaHCO3):(Na2CO3)=2:1
【答案】D
【解析】解:A 根据化学反应,向100mL NaOH溶液中通入一定量的CO2气体,可能发生的反应有:2NaOH+CO2═Na2CO3+H2O或NaOH+CO2═NaHCO3两种可能的情况,再加入盐酸,将Na2CO3或NaHCO3全部反应生成NaCl,根据化学反应中原子守恒,则有n(Na+)=n(Cl﹣),所以n(NaOH)=n(HCl)=0.2mol/L×0.1L=0.02mol,既得c(NaOH)=0.2mol/L,故A错; B 根据题中的图象,加盐酸25mL是与Na2CO3反应,在加盐酸到100mL是与NaHCO3的反应,设溶液中有Na2CO3 xmol,生成NaHCO3 mmol
Na2CO3 + | HCl ═ | NaHCO3+NaCl |
1mol | 1mol | 1mol |
x | 0.025L×0.2mol/L | mmol |
解得:x=0.005mol,m=0.005mol
设75mL盐酸反应的NaHCO3的物质的量ymol,生成zmolCO2 , 则有
NaHCO3+ | HCl ═ | CO2↑+NaCl |
1mol | 1mol | 1mol |
ymol | 0.075L×0.2mol/L | zmol |
解得:y=0.015mol,z=0.015mol
根据原子守恒,加入盐酸恰好完全反应时,共产生CO2 0.015mol,标准状况下的体积为0.336L,故B错;
C所得溶液的溶质成分为Na2CO3、NaHCO3 , 没有NaOH,故C错误;
D根据题中的图象,加盐酸25mL是与Na2CO3反应,在加盐酸到100mL是与NaHCO3的反应,设溶液中有Na2CO3 xmol,生成 NaHCO3 mmol
Na2CO3 + | HCl ═ | NaHCO3+NaCl |
1mol | 1mol | 1mol |
x | 0.025L×0.2mol/L | mmol |
解得:x=0.005mol,m=0.005mol
设75mL盐酸反应的NaHCO3的物质的量ymol,生成zmolCO2 , 则有
NaHCO3+ | HCl ═ | CO2↑+NaCl |
1mol | 1mol | 1mol |
ymol | 0.075L×0.2mol/L | zmol |
解得:y=0.015mol,z=0.015mol
求得通入CO2反应后,Na2CO3 、NaHCO3 的物质的量分别为0.005mol、0.01mol,既得
n( NaHCO3 ):n(Na2CO3)=2:1,故D正确.
故选:D.


科目:高中化学 来源: 题型:
【题目】
(1)电子工业常用FeCl3溶液做腐蚀液制造印刷电路板。用FeCl3做腐蚀液与Cu反应的原理为:2FeCl3+Cu=2FeCl2+CuCl2将一定量铁粉和铜粉的混合物放入等浓度的FeCl3和CuCl2的混合溶液中,可发生多个反应,其中首先发生反应的离子方程式为:。
(2)某校研究性学习小组用已生锈(Fe2O3)的废铁屑制作印刷电路板的腐蚀液(FeCl3溶液),并将刻蚀电路板后的废液再生为FeCl3溶液循环使用。实验流程如下: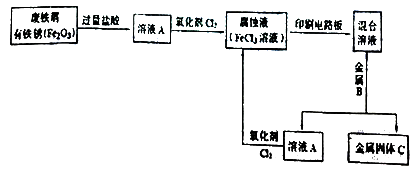
请根据使用流程写出下列反应的离子方程式:
溶液A→腐蚀液:。
混合溶液+金属B→金属固体C:。
(3)检验腐蚀液中Fe3+存在的常用试剂是 , 证明Fe3+存在的现象是。
(4)取适量混合溶液于试管中,加入一定量的铁粉,若反应结束后试管中仍有少量固体,则固体中一定含有 , 溶液中可能含有的金属阳离子是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2 , 充分反应,测得最后溶液的pH>7.
(1)此时溶液的溶质如果是单一成分,可能是;如果是多种成分,可能是 .
(2)在上述所得溶液中,逐滴缓慢滴加2molL﹣1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200mL之前,无气体产生,写出OA段发生反应的离子方程式 .
②B点时,反应所得溶液中溶质的物质的量浓度是(溶液体积的变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环扁桃酯是用于治疗心脑血管疾病的重要化合物,它的一种合成路线如图. 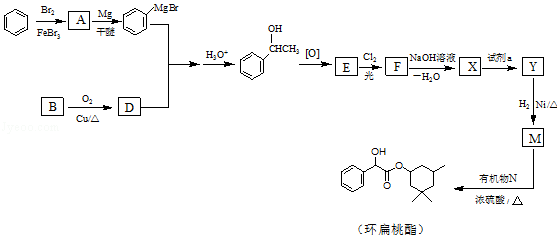
已知: 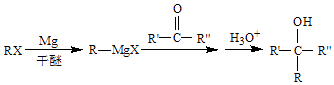 (R、R′、R″代表烃基或氢)
(R、R′、R″代表烃基或氢)
(1)A的结构简式是 .
(2)B→D的化学方程式是 .
(3)红外吸收光谱表明E有C=O键.F的分子式为C8H6Cl2O. ①E的结构简式是 .
②E→F的反应类型是 .
(4)X的结构简式是 .
(5)试剂a是 .
(6)生成环扁桃酯的化学方程式是 .
(7)以CH3CH=CH2、CH3CHO为有机原料,结合题目所给信息,选用必要的无机试剂合成CH2=CHCH=CHCH3 , 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施中,不能提高化学反应速率的是
A. Zn与稀硫酸的反应中,用Zn片代替Zn粉
B. KC103的分解反应中,适当提高反应温度
C. H202的分解反应中,添加适量MnO2
D. 合成氨的反应中,增大体系的总压力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,A为无色有毒气体,B为红棕色粉末,C,E为金属单质,G,J的焰色均为黄色.反应①为炼铁高炉中的重要反应;反应②可用于焊接铁轨. 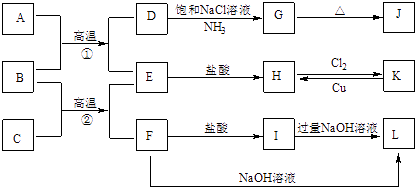
请回答下列问题:
(1)B的化学式为 , J的化学式为 .
(2)工业上将氯气通入石灰乳中制取漂白粉,该反应的化学反应方程式为 .
(3)D→G是侯氏制碱法的主要反应,该反应的化学方程式为 .
(4)K→H是制作印刷电路板的重要反应,该反应的离子方程式为 .
(5)F→L是铝土矿提纯中的重要反应,该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下有可逆反应:A(g)+2B(g)2C(g)+D(g).现将5mol A和10mol B加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是( ) 
A.在0~5min内,正反应速率逐渐增大
B.反应从起始至5min时,B的转化率为50%
C.5min时的平衡常数与10min时的平衡常数不等
D.第15min时,B的体积分数为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色.J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。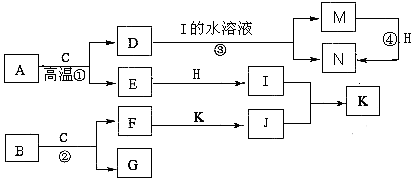
请填写下列空白
(1)写出化学式:M , K。
(2)写出①的化学方程式;写出③的离子方程式。
(3)反应④属于下列何种反应类型______(填字母序号)。
A.化合反应
B.氧化还原反应
C.离子反应
D.置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为______(填序号)。
A.KSCN溶液和氯水
B.铁粉和KSCN
C.浓氨水
D.酸性高锰酸钾溶液
(5)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图示分析正确的是( ) 
A.如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶
B.如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a
C.Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+
D.图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=﹣180 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com