
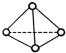
 ��ѧ�Ҽ�����˼��������о������N4���ӣ���ṹΪ���������ͣ���ͼ��ʾ����������ÿ����ԭ��������Ӳ㶼����8���ӽṹ����֪����1mol N-N������192kJ����������1mol N-N������946kJ��������������������ȷ���ǣ�������
��ѧ�Ҽ�����˼��������о������N4���ӣ���ṹΪ���������ͣ���ͼ��ʾ����������ÿ����ԭ��������Ӳ㶼����8���ӽṹ����֪����1mol N-N������192kJ����������1mol N-N������946kJ��������������������ȷ���ǣ�������| A�� | 1molN4����ת��ΪN2ʱҪ����206 kJ���� | |
| B�� | N4��һ�ֱ�N2���ȶ��ķ��� | |
| C�� | 1molN4����ת��ΪN2ʱҪ�ų�740 kJ���� | |
| D�� | N4��N2��ͬλ�� |
���� N4��N2��ֻ��NԪ����ɵIJ�ͬ���ʣ�����Ϊͬ�������壬����N4=2N2����Ϸ�Ӧ�ȵ��ڷ�Ӧ���ܼ��ܼ�ȥ�������ܼ��ܼ��㷴Ӧ�ȣ��ݴ˽��н��
��� �⣺A����N4=2N2��Ӧ�У����ݷ�Ӧ�ȵ��ڷ�Ӧ���ܼ��ܼ�ȥ�������ܼ��ܣ���1molN4����ת��ΪN2�����ջ�ų�������Ϊ��6��192kJ-2��946kJ=-740kJ����˵���÷�Ӧ���ȣ���A����
B��N��N���ܴ���N-N���ܣ�����N2��N4���ȶ�����B����
C����A������֪��1molN4����ת��ΪN2ʱҪ�ų�740 kJ��������C��ȷ��
D��N4��N2������NԪ���γɵIJ�ͬ���ʣ���Ϊͬ�������壬��D����
��ѡC��
���� ���⿼�鷴Ӧ�ȵļ����Լ��йظ�������⣬��Ŀ�ѶȲ���ע�ⷴӦ������ܵļ����ϵ����ȷ�����ȶ����뷴Ӧ�������仯�Ĺ�ϵ������������ѧ�������Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
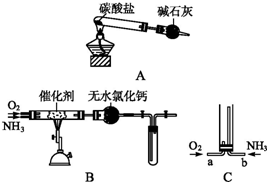
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHS��ˮ�еĵ��뷽��ʽΪ��NaHS�TNa++H++S2- | |
| B�� | ��֪ij�¶���Ksp��CH3COOAg��=2.8��10-3�����¶���Ũ�Ⱦ�Ϊ0.1 mol•L-1��AgNO3��Һ��CH3COONa��Һ��������һ���ܲ���CH3COOAg���� | |
| C�� | 0.1mol/L CH3COOH��Һ��0.05mol/L NaOH��Һ�������ϣ�������Һ�У�2c��H+��+c��CH3COOH��=c��CH3COO-��+2c��OH-�� | |
| D�� | 0.2mol/LNH3•H2O��Һ��0.1mol/L����������Ϻ���Һ�Լ��ԣ���c��Cl-����c��NH4+����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
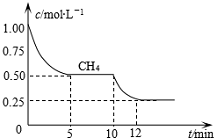
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
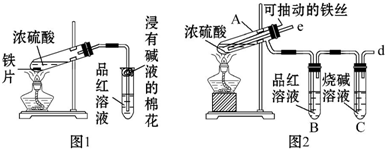
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
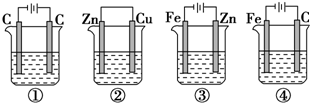
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٣��ڣ��ۣ��� | B�� | �٣��ڣ��ܣ��� | C�� | ��=�ڣ��ۣ��� | D�� | ��=�ڣ���=�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com