
【题目】

(1)原合金中镁的质量为 ;
(2)盐酸的物质的量浓度为 。
【答案】(1)根据图像可知,盐酸是过量的。其中氢氧化镁是11.6g,物质的量是0.2mol;氢氧化铝是19.4g-11.6g=7.8g,物质的量是0.1mol
所以根据原子守恒可知,镁和铝的物质的量分别是是0.2mol和0.1mol
因此质量分别是0.2mol×24g/mol=4.8g、0.1mol×27g/mol=2.7g
(2)Mg2++2OH-=Mg(OH)2↓
0.2mol 0.4mol
Al3++3OH-=Al(OH)3↓
0.1mol 0.3mol
所以消耗氢氧化钠是0.7mol
与过量盐酸的氢氧化钠是5mol/L×0.02L=0.1mol
所以根据原子守恒可知,生成氯化钠是0.8mol
则盐酸的浓度是0.8mol÷0.1L=8mol/L
则溶解氢氧化铝的方程式可知
【解析】试题分析:(1)由图可知:加入20mL氢氧化钠溶液才开始产生沉淀,说明酸过量,先发生了酸碱中和反应,氢氧化钠溶液为160mL时,沉淀量最大,为Mg(OH)2和Al(OH)3,此过程消耗氢氧化钠的物质的量是(0.16-0.02)×5=0.7mol,之后沉淀溶解,溶解的沉淀是Al(OH)3,消耗氢氧化钠20mL, 发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18-0.16)×5=0.1mol,则可知铝离子生成沉淀消耗氢氧化钠0.3mol,所以镁离子生成沉淀消耗氢氧化钠是0.4mol,说明镁离子0.2mol,合金中镁的质量为0.2×24=4.8g
(2)当氢氧化钠溶液为160mL时,沉淀量最大,此时溶液完全为氯化钠溶液,根据钠元素守恒, n(NaCl)=n(NaOH)=0.16×5=0.8mol,再根据氯元素守恒,n(HCl)=n(NaCl)=0.8mol,所以盐酸的物质的量浓度为0.8/0.1="8" mol/L


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】I、实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:
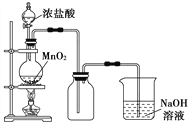
(1)圆底烧瓶中发生反应的化学反应方程式是__________________。
(2)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热(忽略盐酸的挥发),充分反应后生成的氯气明显_________(填大于、等于、小于)0.06 mol。其主要原因有_____________________________;
(3)写出尾气处理的离子方程式是_______________________。
II、用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)应称取Na2CO3·10H2O晶体的质量:____________。定容时,向容量瓶中加水,至1~2cm时,改用_________加水至刻度,加盖摇匀;
(2)下列操作对所配溶液的浓度可能产生影响
①Na2CO3·10H2O晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体(使用游码) ③碳酸钠晶体不纯,其中混有氯化钠 ④容量瓶未经干燥使用。 其中引起所配溶液浓度偏高的有______________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用K2Cr2O7固体与浓盐酸混合加热制备氯气。发生的离子反应如下:
____Cr2O72-+____Cl-+____H+=____Cl2↑+____Cr3++____![]() ,下列有关叙述不正确的是
,下列有关叙述不正确的是
A. 以上各物质对应的计量数依次为1、6、14、3、2、7
B. Cr2O72-发生了还原反应
C. ![]() 处对应的物质是H2O
处对应的物质是H2O
D. 若0.1mol Cr2O72-参加反应,产生氯气物质的量是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔬菜、水果中富含纤维素,纤维素被食入人体后的作用是( )
A.为人体内的化学反应提供原料
B.为维持人体生命活动提供能量
C.加强胃肠蠕动,具有通便功能
D.人体中没有水解纤维素的酶,所以纤维素在人体中没有任何作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:Ka1=____________。
(2)物质的量浓度均为0.1mol/L的六种溶液:
A.CH3COONa、b.Na2CO3、c.NaClO、D.NaHCO3、e.NaSCN f.NaCN
pH由大到小的顺序为___________(用编号填写)。
(3)25℃时,将20mL0.1mol·L-1CH3COOH溶液和20mL0.1mol·L-1HSCN溶液分别与20mL 0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)

(4)25℃时,NaCN与HCN的混合溶液,若测得pH=8,则溶液中
c(Na+)-c(CN-)=________mol/L(填代入数据后的计算式,不必算出具体数值)。
c(CN-)/c(HCN)=____________(填代入数据后的计算式,不必算出具体数值)。
(5)向NaClO溶液中通入少量的CO2,发生反应的离子方程式为_____________。
(6) 25C时,0.18mol/L醋酸钠溶液的pH约为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写方程式:
(1)过氧化钠与CO2反应的化学方程式:__________________________________________
(2)镁条在二氧化碳中燃烧的化学方程式:________________________________________
(3)将少量硫酸铝溶液滴入足量NaOH溶液中的离子方程式:________________________
(4)铁与高温水蒸气反应的化学方程式:______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种工业原料。工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气遇氨会产生白烟
B.该反应利用了氯气的强氧化性
C.该反应属于复分解反应
D.生成1 mol N2有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaCl、Na2SO4、Na3PO4三种溶质的物质的量浓度之比是1:1:2,三种溶液的体积比为2:2:1,则这三种溶液中Na+个数比是
A.1:3:6
B.2:3:9
C.9:3:1
D.1:2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com