
【题目】ClO2代替漂白粉等含氯消毒剂可以减少对人体的危害,但ClO2不易储存和运输,因此将其制成亚氯酸钠。
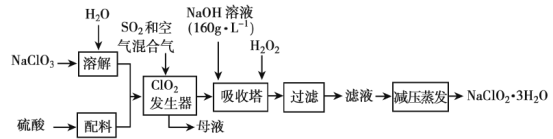
已知:①NaClO2的溶解度随温度升高而增大,温度过高易分解,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(1)在发生器中鼓入空气的作用可能是___(填序号)。
A将SO2氧化成SO3,增强酸性
B稀释ClO2以防止爆炸
C将NaClO3氧化成ClO2
(2)提高“ClO2发生器”反应速率的措施有___。
(3)吸收塔内反应的离子方程式为___。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是___。
(5)测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为___。
②该样品中NaClO2的质量分数为___(用含m、c、V的代数式表示,结果需化简)。
【答案】B 适当升高反应温度、增大吸收液浓度、增大SO2与吸收液的接触面积等 2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2 常压蒸发温度过高,亚氯酸钠容易分解 滴加最后一滴液体时溶液由蓝色变成无色,充分振荡并静置30s不变色 ![]()
【解析】
由制备实验流程可知,固体溶解后与酸混合,在发生器内发生氧化还原反应生成ClO2和Na2SO4,在吸收塔内发生2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑,NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO23H2O。
(1)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全;发生器中鼓入空气的作用应是稀释ClO2以防止爆炸,故答案为B;
(2)结合影响反应速率的因素可知,提高“ClO2发生器”反应速率的措施有升高温度、增大吸收液浓度、增大SO2与吸收液的接触面积等;
(3)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,对应反应的离子方程式为2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2;
(4)NaClO2的溶解度随温度升高而增大,温度过高易分解,故采取“减压蒸发”而不用“常压蒸发”,是为了防止因蒸发温度过高,亚氯酸钠分解;
(5)①因为是用Na2S2O3标准液滴定至终点,反应是I2+2S2O32-=2I-+S4O62-,I2与指示剂淀粉产生蓝色,故终点是滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色;
②由反应中的I元素守恒可知:ClO2-~2I2~4 S2O32-,25.00mL待测溶液中n(NaClO2)=![]() ×cV×10-3mol,m(NaClO2)=
×cV×10-3mol,m(NaClO2)=![]() ×90.5cV×10-3g;样品mg配成250mL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为
×90.5cV×10-3g;样品mg配成250mL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为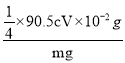 ×100%=
×100%=![]() 。
。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法正确的是( )
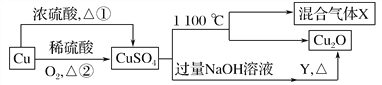
A. 相对于途径②,途径①更好地体现了绿色化学思想
B. Y可以是葡萄糖溶液
C. X可能是SO2和SO3的混合气体
D. 将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的一氯代物有两种,二氯代物有四种的是( )
A.CH3CH3B.CH3CH2CH3C.CH3CH2CH2CH3D.(CH3)2CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(1)已知CO(g)、H2(g)的标准燃烧热分别为 △H=-283kJmol-1, △H=-286kJmol-1,且CH3OH(g)+3/2O2(g) ![]() CO2(g)+2H2O(l) △H=-761kJmol-1;则CO(g)+ 2H2(g)
CO2(g)+2H2O(l) △H=-761kJmol-1;则CO(g)+ 2H2(g)![]() CH3OH(g)的△H= ___________。
CH3OH(g)的△H= ___________。
(2)为了提高CO和H2制备甲醇生产效率和产量;工业生产中通常采取的措施是___________________________________________。(写出两点)
(3)实验室模拟用CO和H2反应来制甲醇,在250 ℃下,将一定量的CO和H2投入10 L的密闭容器中,各物质的物质的量浓度(mol·L-1)变化如下表所示:
2 min | 4 min | 6 min | |
CO | 0.07 | 0.05 | 0.05 |
H2 | x | 0.10 | 0.10 |
CH3OH | 0.03 | 0.05 | 0.05 |
①250 ℃时,该反应的平衡常数K=___________;
②在图1中画出反应开始至第6 min时H2的物质的量的变化曲线,并标出合适的纵坐标。_______
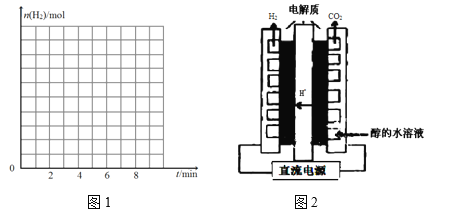
(4)利用电解甲醇水溶液制备氢气最大的优点就是需要的电压低,装置如图2,写出 阳极电极反应方程式____________________________________________________,电解的总反应化学方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁与铜的粉末按物质的量之比为2︰1的比例混合均匀,取出mg混合物,投入到100mL 3mol·L-1FeCl3溶液中,充分反应(反应后溶液体积变化忽略不计)。试计算:
(1)如果固体完全溶解,则m最大值为____。
(2)如果溶液中Cu2+浓度为0.25 mol·L-1,则m值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
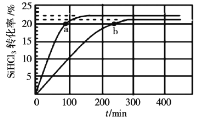
【题目】已知:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH=Q kJ·mol-1,其平衡常数随温度变化如表所示:
温度/k | 323 | 343 | 400 |
平衡常数 | 0.01 | 0.02 | 1 |
在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
请回答下列问题:
(1)该反应的Q___0(填“>”或“<”)。
(2)代表323K曲线的是___(填a或b)
(3)在400K下,要缩短反应达到平衡的时间,可采取的措施有___、___。
(4)已知2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)的反应速率v=v正-v逆,其中v正=k正x2SiHCl3,v逆=k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___。
=___。
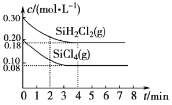
(5)TK时在体积为10L的反应器中,通入一定量的SiH2Cl2(g)和SiCl4(g),发生上述反应,SiH2Cl2(g)和SiCl4(g)浓度变化如图所示,则0~4 min时平均反应速率v(SiCl4(g))=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究白色固体X(仅含两种元素)的组成和性质,设计并完成如下实验(所加试剂都是过量的):
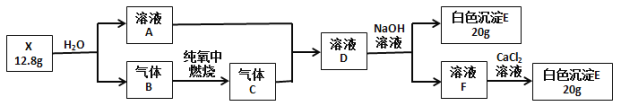
其中气体B在标准状况下的密度为1.16 g·L-1请回答:
(1) X的化学式是________。
(2) 气体B的电子式________。
(3) 溶液D与NaOH溶液反应的离子反应方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、硫、氯的化合物种类繁多,应用广泛。
(1)工业中可用POF3合成杀虫农药,组成该物质的三种元素的电负性由大到小的顺序是______。
(2)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质存在的化学键有离子键、共价键和_____。
(3)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是离子晶体;碳原子采取sp杂化,1mol该物质中含有的π键数目为____。
②H2O2常温下是液体,沸点较高(150℃),其主要原因是____。
(4)SO3和O3的混合气体经光解作用,可生成一种结构如图所示的物质,该物质中S原子的轨道杂化方式是____,该分子属于___(填“极性分子”或“非极性分子”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是锂—空气电池的放电原理图(隔膜只允许锂离子通过)。电池放电时的反应可表示为:4Li+O2+2H2O=4LiOH。下列锂—空气电池放电时的有关说法正确的是( )

A. 正极反应式:Li-e-=Li+
B. 每转移2mol电子,消耗11.2L的O2
C. Li+不断向电池的正极移动
D. 可以去掉隔膜和有机电解液,让金属锂与水性电解液直接接触
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com