
【题目】下列反应中,符合如图所示能量变化的是( ) 
A.H2在Cl2中燃烧
B.Ba(OH)28H2O和NH4Cl固体的反应
C.Na和H2O的反应
D.生石灰溶于水
【答案】B
【解析】解:根据图像可知,生成物具有的总能量高于反应物具有的总能量,该反应为吸热反应, A.H2在Cl2中燃烧的反应为放热反应,不满足条件,故A错误;
B.NH4Cl晶体与Ba(OH)28H2O混合搅拌反应是吸热反应,满足条件,故B正确;
C.钠与水的反应为放热反应,不满足条件,故C错误;
D.CaO溶于水生成Ca(OH)2反应是放热反应,与图像不相符,故D错误;
故选B.
根据图像可知,生成物具有的总能量高于反应物具有的总能量,该反应为吸热反应,①放热反应:有热量放出的化学反应,因为反应物具有的总能量高于生成物具有的总能量.常见放热反应:燃烧与缓慢氧化,中和反应;金属与酸反应制取氢气,生石灰和水反应等.②吸热反应:有热量吸收的化学反应,因为反应物具有的总能量低于生成物具有的总能量.常见的吸热反应:C(s)+H2O(g)→CO(g)+H2O; C+CO2→CO的反应,以及KClO3、KMnO4、CaCO3的分解等,据此进行解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( ) 
A.Be、Na、Al
B.B,Mg、Si
C.O,P,Cl
D.C,Al、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2 , 他们使用的药品和装置如下图所示: 
(1)装置C的作用是 .
(2)若要从FeSO4溶液获得FeSO47H2O晶体,必须进行的实验操作步骤:、、过滤、洗涤、自然干燥.
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应. ①写出SO2与FeCl3溶液反应的离子方程式;
②请写出检验A烧杯中有Fe2+生成的操作方法;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣ . 该做法(填“合理”或“不合理”),理由是 .
(4)能表明I﹣的还原性弱于SO2的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当光束通过下列物质时,不会出现丁达尔效应的是
①稀豆浆 ②蒸馏水 ③硫酸铜稀溶液 ④FeCl3稀溶液 ⑤云雾
A.②④⑤B.①③④C.②③④D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应X2+3Y22Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( ) 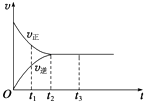
A.t1时,只有正方向反应
B.t2时,反应达到限度
C.t2~t3 , 反应不再发生
D.t2~t3 , 各物质的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜在生产、生活中应用广泛.某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如图: 
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式: .
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是 .
(3)滤渣c是 .
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为 2NO+O2═2NO2、 .
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3):n(SO2)=1:2,写出硫酸铜受热分解的化学方程式: .
(6)某同学设计了如图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积.此设计有不合理之处,请说明理由: . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:
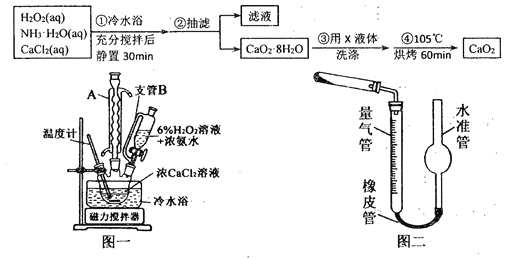
请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为:___________________________;
(2)仪器A的名称___________________,三颈烧瓶右口连接的是恒压分液漏斗,其支管B的作用是____________________________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是__________(填写正确答案的序号,下同)
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这利用了过氧化钙以下哪些性质____________;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体),准确称取1.000g样品,置于试管中加热使其完全分解,收集到67.20mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________(保留4位有效数字);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com