
【题目】1L某混合溶液中,溶质X,Y的浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol/L的氢氧化钠或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化关系如图所示,则X,Y,Z分别是( ) 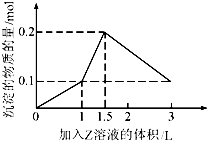
A.AlCl3、FeCl3、NaOH
B.AlCl3、MgCl2、NaOH
C.NaAlO2、Ba(OH)2、H2SO4
D.NaAlO2、BaCl2、H2SO4
【答案】C
【解析】解:A.若X、Y、Z分别为氯化铝、氯化铁、氢氧化钠,开始滴入氢氧化钠时,Al3++3OH﹣=Al(OH)3↓,Fe3++3OH﹣=Fe(OH)3↓,n(Al3+):n(OH﹣)=1:3,n(Fe3+):n(OH﹣)=1:3,继续滴加Al(OH)3+OH﹣=AlO2﹣+2H2O,n(Al(OH)3):n(OH﹣)=1:1,不符合图象的数值变化,故A错误;
B.若X、Y、Z分别为氯化铝、氯化镁、氢氧化钠,开始滴入氢氧化钠时,Mg2++2OH﹣=Mg(OH)2↓,Al3++3OH﹣=Al(OH)3↓,n(Mg2+):n(OH﹣)=1:2,n(Al3+):n(OH﹣)=1:3,继续滴加Al(OH)3+OH﹣=AlO2﹣+2H2O,n(Al(OH)3):n(OH﹣)=1:1,不符合图象的数值变化,故B错误;
C.若X、Y、Z分别为偏铝酸钠、氢氧化钡、硫酸,开始滴入硫酸时OH﹣+H+=H2O,Ba2++SO42﹣=BaSO4↓,
H++AlO2﹣+H2O=Al(OH)3↓,
图中第一段直线:氢氧化钡的OH﹣和硫酸里的H+1:1中和,同时Ba2+和SO42﹣1:1反应生成硫酸钡沉淀,
Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O;
图中第二段直线氢氧化钡消耗完,硫酸继续滴加,氢离子开始和偏铝酸根离子反应H++AlO2﹣+H2O=Al(OH)3↓,硫酸的消耗量(硫酸消耗量是氢离子消耗量的一半)和沉淀的生成量是1:2;
图中第三段直线:硫酸进一步过量,开始消耗沉淀,Al(OH)3+3H+=Al3++3H2O硫酸和沉淀消耗量应为1.5:1直到把氢氧化铝完全溶解,只剩下不溶于酸的BaSO4 , 以上三段符合图象的数值变化,故C正确;
D.若X、Y、Z分别为偏铝酸钠、氯化钡、硫酸,滴入硫酸时Ba2++SO42﹣=BaSO4↓,H++AlO2﹣+H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,生成最大量沉淀氢氧化铝0.1mol,需要硫酸0.05mol;生成硫酸钡沉淀0.05mol,需要硫酸0.05mol,图中第一段直线不符合,故D错误;
故选C.
根据图象分析,若Z为氢氧化钠溶液,Mg2++2OH﹣=Mg(OH)2↓,Al3++3OH﹣=Al(OH)3↓,Fe3++3OH﹣=Fe(OH)3↓,Al(OH)3+OH﹣=AlO2﹣+2H2O,溶液中沉淀量达到最大时,生成氢氧化铝沉淀、氢氧化铁沉淀、氢氧化镁沉淀时沉淀物质的量和消耗的碱的物质的量不符合,X不能是铝盐;所以Z是硫酸溶液,据此解答.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】如图所示的装置,C,D,E,F,X,Y都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.则以下说法不正确的是 ( ) 
A.电源B极是负极
B.甲、乙装置的C,D, E,F电极均有单质生成,其物质的量之比为1:2:2:2
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.20g Cu跟50.0mL 10.0molL﹣1的HNO3充分反应,还原产物有NO和NO2 , 若反应后溶液中有xmol H+ , 则此时溶液中含NO3﹣的物质的量为( )
A.![]() mol
mol
B.(x+0.1)mol
C.2x mol
D.0.1x mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个数据都表示合成氨的反应速率,其中速率代表同一反应中的是( ) ①V(N2)=0.6mol/(Lmin) ②V(NH3)=1.8mol/(Lmin)
③V(H2)=1.2mol/(Lmin) ④V(H2)=0.045mol/(Ls)
A.①②
B.①③
C.③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞机用的铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4 ![]() N2↑+4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )
N2↑+4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )
A.反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X+Y=M+N为吸热反应。下列关于该反应的说法中,正确的是( )
A. Y的能量一定低于N
B. X、Y的能量总和高于M、N的能量总和
C. 因为该反应为吸热反应,故一定要加热才能发生
D. 断裂X、Y的化学键所吸收的能量高于形成M、N的化学键所放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 , 请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为 .
(2)写出该反应的化学方程式 . 若反应中生成0.2mol HNO3 , 转移的电子数目为个.
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是 .
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是啊
A. 1000mL,212g B. 950mL,201.4g
C. 任意规格,572g D. 500mL,286g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5molL﹣1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL
B.45 mL
C.30 mL
D.15 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com