
【题目】如图所示,甲装置可直接除去城市废水中的尿素,既能产生净化的水,又能发电。乙装置可用于人工肾脏间接电化学方法除去代谢产物中的尿素的工作原理。下列关于描述正确的是

A.甲乙装置连接是a接c、b接d
B.甲装置工作时H+移向负极
C.乙装置阴极室溶液的pH与电解前相比将升高
D.a和c电极都发生CO(NH2)2-6e-+H2O==N2↑+CO2↑+6H+
【答案】D
【解析】
试题分析:由图可知,甲装置为燃料电池,a极为负极,b极为正极。乙装置为电解池,根据化合价升降可知c极为阳极,d极为阴极。则有:A.甲乙装置连接是a接d、b接c,错误;B.甲装置为原电池,电池工作时根据同种电荷相互排斥,异种电荷相互吸引的原则,H + 移向负电荷较多的正极,工作时H+移向负极,错误;C.乙装置阴极反应为6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑),阳极反应为6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变,错误;D.甲装置a极为负极,乙装置c极为阳极,都发生的是氧化反应,因此电极方程式都为CO(NH2)2-6e-+H2O==N2↑+CO2↑+6H+,正确。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( ) 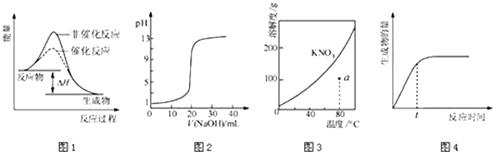
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000molL﹣1NaOH溶液滴定20.00mL0.1000molL﹣1CH3COOH溶液所得到的滴定曲线
C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分. 
(1)其中代表金刚石的是(填编号字母,下同) , 金刚石中每个碳原子与个碳原子最接近且距离相等.金刚石属于晶体;
(2)其中代表石墨是 , 其中每个正六边形占有的碳原子数平均为个;
(3)代表干冰的是 , 它属于晶体,每个CO2分子与个CO2分子紧邻;
(4)上述三种物质熔点由高到低的排列顺序为 .
(5)含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大,即(HO)mROn中,n值越大,酸性越 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中能证明碳的非金属性比硅强的是( )
①往Na2SiO3溶液中通入CO2产生白色沉淀
②石墨是导体,晶体硅是半导体
③制玻璃过程中发生反应Na2CO3+SiO2 ![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
④CH4比SiH4稳定.
A.①④
B.②③
C.③④
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和Cl2的漂白性,设计了如下的实验装置。

(1)实验室常用软锰矿(主要成分是MnO2)与浓盐酸混合加热的方法制备Cl2,写出实验室制备氯气的化学方程式:________________________________________________。在此化学反应中,氧化剂与还原剂的物质的量之比为____________;若反应过程中转移电子的物质的量为6 mol,则生成氯气的物质的量为____________mol。
(2)反应开始一段时间后, B、D两个试管中的品红溶液出现的现象是: B:_______________________; D:________________________;
(3)停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别是:B:_______________________; D:________________________;
(4)实验中NaOH溶液的作用是________________________________________。若将C中NaOH溶液换成水,当通入物质的量比为1:1的SO2和Cl2,恰好反应生成两种强酸(其中一种是含氧酸,另一种是无氧酸),该反应的化学方程式是:_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
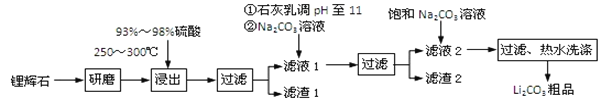
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 氯化钠溶液在电流作用下电离成Na+与Cl
B. 溶于水后能电离出H+的化合物都是酸
C. 氯化氢水溶液能导电,所以氯化氢是电解质
D. O2的水溶液能不导电,所以O2是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Al(NO3)3溶液的叙述正确的是( )
A.该溶液中H+、Fe2+、SO ![]() 、Cl﹣可以大量共存
、Cl﹣可以大量共存
B.向该溶液中通入SO2气体不会发生反应
C.向该溶液中加入过量氨水发生反应的离子方程式Al3++4NH3?H2O═AlO2﹣+4NH4++2H2O:
D.向该溶液中滴入Na2CO3溶液发生反应的离子方程式:2Al3++3CO ![]() +3 H2O═2Al(OH)3↓+3CO2↑
+3 H2O═2Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于相同质量的二氧化硫和三氧化硫来说,下列关系正确的是( )
A. 含氧原子的个数比为2∶3 B. 含硫元素的质量比是5∶4
C. 含氧元素的质量比为5∶4 D. 含硫原子的个数比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com