
【题目】反应:aA(g)+bB(g) ![]() cC(g)+dD(g)
cC(g)+dD(g)![]() H,学习小组针对反应特点与对应的图象展开了讨论,其中不正确的是
H,学习小组针对反应特点与对应的图象展开了讨论,其中不正确的是
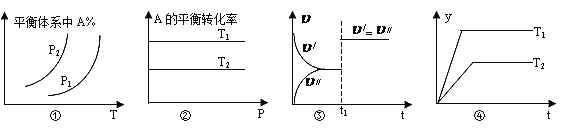
A. 图①中,若p1>p2,则该反应在较低温度下有利于自发进行
B. 图②中,若T2>T1,则![]() H<0且a+b=c+d
H<0且a+b=c+d
C. 图③中(υ/表示正反应速率,υ//表示逆反应速率),t1时刻改变的条件一定是使用了催化剂
D. 图④中,若![]() H<0,则纵坐标不可能表示的是反应物的转化率
H<0,则纵坐标不可能表示的是反应物的转化率
【答案】C
【解析】试题分析:A. 图①中,若P1>P2,增大压强,平衡体系中A的百分含量减小,说明平衡正向移动,增大压强,平衡向系数减小的方向进行,则该反应是熵减的可逆反应,该反应在较低温度下有利于自发进行,A项正确;B. 图②中,若T2>T1,升高温度,A的平衡转化率降低,说明平衡逆向移动,升高温度,平衡向吸热反应方向移动,则其正反应为放热反应,![]() H<0,增大压强,平衡不移动,所以该反应是气体体积不发生变化的可逆反应,则a+b=c+d,B项正确;C.对于气体体积不发生变化的可逆反应,增大压强,加快了化学反应速率但平衡不移动,在图③中,t1时刻改变的条件可能是使用了催化剂或增大了压强,C项错误;D.图④中,若
H<0,增大压强,平衡不移动,所以该反应是气体体积不发生变化的可逆反应,则a+b=c+d,B项正确;C.对于气体体积不发生变化的可逆反应,增大压强,加快了化学反应速率但平衡不移动,在图③中,t1时刻改变的条件可能是使用了催化剂或增大了压强,C项错误;D.图④中,若![]() H<0,根据“先拐先平,温高压大”, T2<T1,升高温度,平衡逆向移动,反应物的转化率降低,则纵坐标不可能表示的是反应物的转化率,D项正确;选C。
H<0,根据“先拐先平,温高压大”, T2<T1,升高温度,平衡逆向移动,反应物的转化率降低,则纵坐标不可能表示的是反应物的转化率,D项正确;选C。


科目:高中化学 来源: 题型:
【题目】同分异构现象是有机物种类繁多的重要原因之一,下列互为同分异构体的一组化合物是( )
A. 甲烷和乙烷 B. 正丁烷和异丁烷
C. 乙醇和乙酸 D. 乙烯和聚乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
实验 |
| 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 .
(2)在实验2,A的初始浓度c2=mol/L,推测实验2中还隐含的条件是 .
(3)设实验3的反应速率为v3 , 实验1的反应速率为v1 , 则v3v1(填>、<、=),且c31.0mol/L(填>、<、=).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在离子RO3n-中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是( )
A. A-x+n+48 B. A-x+n+24 C. A-x-n-24 D. A+x-n-24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质分类全部正确的是
①纯碱 ②食盐水 ③石灰水 ④NaOH ⑤液态氧 ⑥KClO3
A. 碱——①④ B. 纯净物——③④⑤
C. 盐——①⑥ D. 混合物——②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子不能大量共存的是
A. NH4+、Fe3+、SO42一、NO3一B. Na+、Ca2+、Cl一、CO32一
C. K+、Na+、SO42一、S2一D. K+、Na+、Cl一、NO3一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题: 
(1)L代表的元素处于常见周期表的位置是 , 该单质与A2E反应的方程式为: .
(2)元素F、G、I、K、M的原子半径由大到小的顺序是 , 其对应离子的离子半径由大到小的顺序是(用元素或离子符号表示).
(3)用电子式表示MO2:、用电子式表示CJ2的形成过程:
(4)F、G、M三种元素最高价氧化物对应的水化物碱性最强的是(填化学式);比较元素C和J的非金属性强弱,C的非金属性于J(填“强”或“弱”),并用化学方程式证明上述结论 .
(5)元素B和N形成的化合物的水溶液与元素K的单质反应的离子方程式为: , 反应后,向溶液中加入C、K形成的化合物溶液,现象为 .
(6)A与E和A与J均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如下所示。

请回答下列问题:
(1)操作Ⅰ为 。
(2)①加入H2O2发生的主要反应的离子方程式为 ;
②加入碳酸钠溶液调pH至4.0~5.0,其目的为 ;
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体。NiC2O4受热分解的化学方程式为 。
(4)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com