
登山运动员常利用氢化钙固体作为能源提供剂。某兴趣小组用纯净干燥的氢气和金属钙制取氢化钙,所选装置图如下:


A B C D E
图1
查阅资料:①钙易与水反应生成碱和气体。
②氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。
(1)请按气流方向连接顺序i接( ),( )接( ),( )接( ),k接 a
(填仪器接口的字母编号)。
(2)装置A的作用是 ;装置C的作用是 。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞, (请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(4)甲同学设计一个实验,测定上述实验中得到的氢化钙的纯度。请完善下列实验步骤。
 ①样品称量 ②加入足量的________溶液(填化学式),搅拌、过滤 ③_______、________(填操作名称) ④称量碳酸钙的质量
①样品称量 ②加入足量的________溶液(填化学式),搅拌、过滤 ③_______、________(填操作名称) ④称量碳酸钙的质量
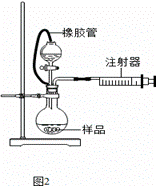
(5)乙同学利用图2装置测定上述实验中得到的氢化钙的纯度。他称取46 mg 所制得的氢化钙样品,记录开始时注射器活栓停留在10.00 mL刻度处,反应结束后充分冷却,活栓最终停留在57.04 mL刻度处。(上述气体体积均在标准状况下测定)
试通过计算求样品中氢化钙的纯度: 。(计算结果保留一位小数)
科目:高中化学 来源: 题型:
面对能源与环境等问题,全球大力发展新能源的同时,还倡导节能减排、低碳经济。请回答下列问题:
Ⅰ、氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: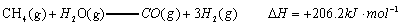
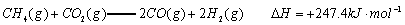
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。 与
与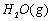 反应生成CO2(g)和
反应生成CO2(g)和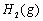 的热化学方程式为 。
的热化学方程式为 。
(2)电解尿素CO(NH2)2的碱性溶液制氢的装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。
 (3)
(3)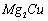 是一种储氢合金。350℃时,
是一种储氢合金。350℃时,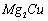 与
与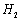 反
反
应,生成MgCu2和仅含一种金属元素的氢化物(其中
氢的质量分数为0.077)。则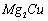 与
与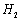 反应的化学
反应的化学
方程式为 。
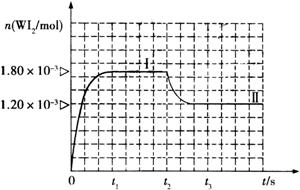 Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应:
Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应: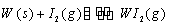 。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的
。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的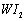 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象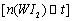 ,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
(4)该反应是 (填写“放热”或“吸
热”)反应。在450℃时,该反应的平
衡常数K= 。
(5)若保持450℃温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量 (填“变大”、“不变”或“变小”)。
(6)若保持450℃温度不变,向该容器中再加入0.002 mol W、0.000 6 mol I2、0.0054 mol WI2,则化学平衡 (填“正向移动”、“不移动”或“逆向移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol·(L·s)-1是指1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
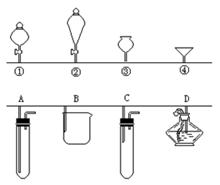
如图中的①、②、③、④分别是几种常见漏斗的上部,A、B、C、D分别是实际操作(分液、制气、向容器中加液体试剂等)时,各漏斗的下部插入容器中的示意图。请根据实际使用操作时上述漏斗的使用范围和它们形状,下列哪一种匹配是不合适的
A. 制备二氧化碳:A与 ③
B. 过滤:B与 ④
C. 用双氧水和二氧化锰制氧气:C与 ①
D. 添加酒精:D与 ②
查看答案和解析>>
科目:高中化学 来源: 题型:
在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体产生。则下列结论正确的是
A.滤液中一定有Fe(NO3)3
B.滤渣只含Ag和Cu,一定无Zn
C.滤渣中一定有Ag、Cu和Fe,一定无Zn
D.滤渣中可能有Ag、Cu、Fe和Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能用勒沙特列原理来解释的是 ( )
A.H2、I2、HI平衡混合气加压后颜色变深。
B.加入催化剂有利于合成NH3的反应。
C.高压有利于合成NH3的反应 。
D.500℃左右比室温更有利于合成NH3的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
A.K1闭合,铁棒上发生的反应为2H++2e=H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体

查看答案和解析>>
科目:高中化学 来源: 题型:
下列数据是对应物质的熔点
| Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 920 | 801 | 1291 | 190 | -107 | 2073 | -57 | 1723 |
据此做出的下列判断中错误的是
A.铝的化合物的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
溴乙烷中含有少量乙醇杂质,下列方法中可以除去该杂质的是( )
A.加水振荡,静置分层后,用分液漏斗分离去水层
B.加入氢溴酸并加热,使乙醇转化为溴乙烷
C.加入金属钠,使乙醇发生反应而除去
D.加入浓硫酸并加热到170℃,使乙醇变成乙烯而逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com