
【题目】下图为足量铜与浓硫酸反应的装置。请回答:
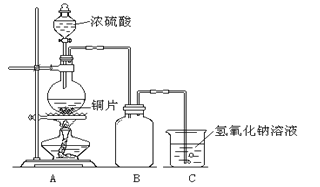
(1)写出盛放有铜片的仪器名称____________。
(2)检查装置气密性的操作为____________。
(3)下列有关该实验的说法中正确的是____________。
A.烧杯中氢氧化钠溶液的作用是吸收尾气,防止空气污染
B.实验时可以观察到圆底烧瓶中溶液由无色最终变为蓝色
C.含 0.08 mol 溶质的浓硫酸与足量的铜片反应,能收集到896mL(标准状况)的SO2
D.在该实验中浓硫酸体现了酸性和强氧化性
E.如果 B 中盛有少量 KMnO4 溶液,反应一段时间后,可以观察到紫色褪去,说明SO2具有漂白性。
【答案】圆底烧瓶连接好装置,关闭分液漏斗旋塞,将导管末端插入水中,给圆底烧瓶微热(或用手掌紧捂圆底烧瓶外壁),如果导管口产生气泡,停止微热后(或移开手掌后)导管内形成一段稳定的水柱,说明气密性良好AD
【解析】
(1)铜片盛放在圆底烧瓶中在加热条件下与浓硫酸反应;
(2)连接好该装置,关闭分液漏斗旋塞,将导管末端插入水中,给圆底烧瓶微热(或用手掌紧捂圆底烧瓶外壁),如果导管口产生气泡,停止微热后(或移开手掌后)导管内形成一段稳定的水柱,说明气密性良好
(3)A.尾气SO2有毒,对环境有污染,但能溶解于NaOH溶液,可利用氢氧化钠溶液吸收其尾气,防止空气污染,故A正确;B.因选用的是浓硫酸,生成的CuSO4以固体形式析出在烧杯底部,无法观察到圆底烧瓶中溶液由无色最终变为蓝色,故B错误;C.随反应的进行,当硫酸浓度降低后,铜和稀硫酸不再反应,故C错误;D.在铜和浓硫酸的反应中,体现了浓硫酸的酸性和强氧化性,故D正确;E.SO2具有还原性,能使酸性 KMnO4 溶液紫色褪去,故E错误;答案为AD。


科目:高中化学 来源: 题型:
【题目】
有机物A~K有如下转化关系,E、H能与FeCl3溶液发生显色反应,I转化的产K只有一种结构,且K能使溴的CCl4溶液褪色。
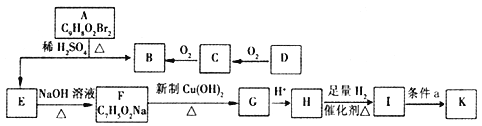
已知:① D的质谱与核磁共振氢谱图如下:
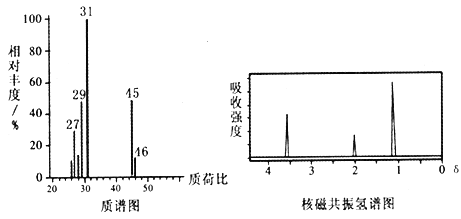
② 两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:CH3CH(OH)2→CH3CHO + H2O。
请回答下列问题:
(1)C中官能团的名称是_______;H→I的反应类型是__________。
(2)K的结构简式为________;条件a为______。
(3)写出下列反应的化学方程式:
①F→G_________。
②A→B + E__________________。
(4)L是相对分子质量比H大14的同系物,同时符合下列条件L 的同分异构体有____种。
a.与FeCl3溶液有显色反应 b.能与NaHCO3溶液发生反应
其中苯环上的一溴代物只有两种的L的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 铁和盐酸溶液反应:2Fe + 6H+ === 2Fe3+ +3 H2↑
B. 氯气和水反应:Cl2 + H2O![]() 2 H+ + Cl- + ClO
2 H+ + Cl- + ClO
C. 氢氧化钡溶液与硫酸铜溶液反应:Ba2+ + SO42- = BaSO4↓
D. 氯化铁溶液与氨水溶液反应: Fe3+ + 3 NH3·H2O === Fe (OH)3 ↓+ 3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.只含一种元素的物质一定是单质 B.只含一种分子的物质一定纯净物
C.非金属氧化物一定是酸性氧化物 D.有单质生成的反应一定是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+
B.加入K3[Fe(CN)6]溶液,产生特征蓝色沉淀,则原溶液一定有Fe3+
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42-
D.加入NaOH溶液,产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低浓度SO2废气的处理是工业难题,工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
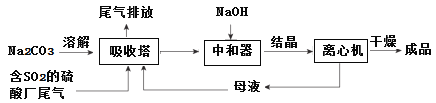
(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合
理措施______________、_______________。(写出两条)
(2)中和器中发生的主要反应的离子方程式是_____________________。
(3)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。
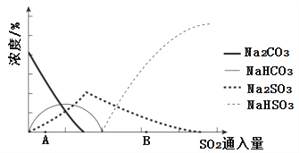
①则初期反应(图中A点以前)的化学方程式是__________________。
②通过电解法可分离图中B点NaHSO3与Na2SO3混合物,实现Na2SO3的循环利用,示意图如下:
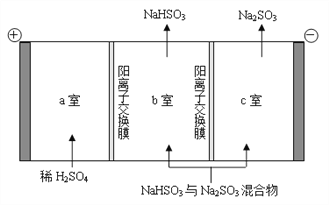
简述分离NaHSO3与Na2SO3混合物的原理___________________。
(4)下图是亚硫酸钠的溶解度曲线(温度在33℃前后对应不同物质),下列说法正确的是______
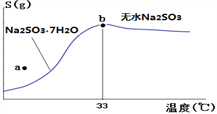
A.a点时溶液为不饱和溶液
B.b点时Na2SO3·7H2O和无水Na2SO3共存
C.制备无水Na2SO3,应该在95~100℃加热浓缩,冷却至室温结晶
(5)如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是__________
A.Na2SO3 B.Na2S C.Ba(NO3)2 D.酸性KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子数目,按由大到小顺序排列的是
①0.5mol NH3 ②标准状况下22.4L He ③4℃ 9mL水 ④19.6g H3PO4
A.①④③② B.④③②① C.②③④① D.①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①移去生成物②升高温度③增大压强④增大反应物的浓度⑤加入催化剂.
A.①②③④⑤
B.②③④⑤
C.②⑤
D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com