
【题目】氧是地壳中含量最多的元素.
(1)氧元素基态原子核外未成对电子数为个.
(2)①H2O分子内的O﹣H键、②分子间的范德华力和③氢键从强到弱依次为(填序号即可) .
(3)对羟基苯甲醛的沸点比邻羟基苯甲醛高,理由是 .
(4)H+可与H2O形成H3O+ , H3O+中O原子采用杂化轨道.H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为
【答案】
(1)2
(2)①>③>②
(3)![]() 形成分子内氢键,而
形成分子内氢键,而 ![]() 形成分子间氢键,分子间氢键使分子间作用力增大
形成分子间氢键,分子间氢键使分子间作用力增大
(4)sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小
【解析】解:(1)O元素原子核外有8个电子,其2p轨道上有4个电子,分别位于3个轨道上,所以氧元素基态原子核外未成对电子数为2个,所以答案是:2;(2)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O﹣H键、分子间的范德华力和氢键从强到弱依次为①>③>②,所以答案是:①>③>②;(3)含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键,所以答案是: ![]() 形成分子内氢键,而
形成分子内氢键,而 ![]() 形成分子间氢键,分子间氢键使分子间作用力增大;(4)H3O+中O原子价层电子对个数=3+
形成分子间氢键,分子间氢键使分子间作用力增大;(4)H3O+中O原子价层电子对个数=3+ ![]() =4,根据价层电子对互斥理论判断O原子采用sp3杂化;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,
=4,根据价层电子对互斥理论判断O原子采用sp3杂化;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,
所以答案是:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
【考点精析】掌握氢键的存在对物质性质的影响是解答本题的根本,需要知道氢键主要存在于HF、H2O、NH3、CH3CH2OH分子间;故HF、H2O、NH3的沸点分别与同族氢化物沸点相比反常的高.


科目:高中化学 来源: 题型:
【题目】下表中是各组反应的反应物和温度,反应刚开始时,放出H2速率最快的是( )
编号 金属(粉末状) 酸的浓度及体积 反应温度 |
A Mg,0.1 6 mol·L-1 硝酸10mL 80 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅资料发现,金属钠不仅能与氧气和水反应,还能与很多种其他物质发生反应,其中包括与酒精在常温下反应,要研究金属钠和酒精、金属钠和水反应的异同点,下列的研究方法中用不到的是( )
A.观察法
B.分类法
C.实验法
D.比较法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)“毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240 g/mol-1 ;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%氧元素的质量分数为28%,其余为N、S。(写计算过程)
(1)误食0.1 g“毒鼠强”就可以使人死亡,0.1g“毒鼠强”的物质的量为多少?
(2)试求“毒鼠强”中C、H、O三种元素的原子个数比。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E 均为中学化学常见物质,它们之间的转化关系如图所示(部分产物略去,①②③④的反应条件相同).则A、E 可能的组合为( ) 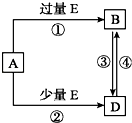
①CO2、NaOH 溶液 ②NaCl溶液、Ca(OH)2 溶液③Fe、稀HNO3 ④Na、O2 ⑤CuO,C ⑥AlCl3 溶液、NH3H2O.
A.②③④⑤
B.①③④⑤⑥
C.①②③⑤⑥
D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Na2O2可以作为呼吸面具或潜水艇里的氧气来源
B. 将Na2O加到酚酞溶液中,溶液先变红色后褪色
C. 可用水来检验某Na2O样品中是否含有Na2O2
D. 过氧化钠为淡黄色固体粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体.有关物质间的转化关系如图(图中部分反应物或产物已省略):
请填空:
(1)B的电子式为;I分子的空间构型为 .
(2)反应②的实验现象为 .
(3)操作a必须在HCl气流中加热得无水物,其原因是;操作b为 .
(4)反应①的离子反应方程式为;反应③的化学反应方程式为 .
(5)已知C的燃烧热为286 kJ/mol,请写出表示1g C在F中完全燃烧生成液体G的热化学反应方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com