
【题目】已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体.有关物质间的转化关系如图(图中部分反应物或产物已省略):
请填空:
(1)B的电子式为;I分子的空间构型为 .
(2)反应②的实验现象为 .
(3)操作a必须在HCl气流中加热得无水物,其原因是;操作b为 .
(4)反应①的离子反应方程式为;反应③的化学反应方程式为 .
(5)已知C的燃烧热为286 kJ/mol,请写出表示1g C在F中完全燃烧生成液体G的热化学反应方程式 .
【答案】
(1)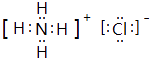 ;直线形
;直线形
(2)燃烧,发光发热,有黑色与白色固体物质生成
(3)抑制Mg2+的水解;熔融状态下电解
(4)Mg+2NH4+═Mg2++H2↑+2NH3↑;4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(5)![]() H2(g)+
H2(g)+ ![]() O2(g)=
O2(g)= ![]() H2O(g)△H=﹣143kJ/mol
H2O(g)△H=﹣143kJ/mol
【解析】解:E对空气的相对密度为0.586,其相对分子质量=0.586×29=17,且E为气体,可推知E为NH3 , E与F连续反应得到K,且F、J、K均为气体,可推知F为O2、J为NO、K为NO2 , 常温常压下G为液体,与K反应得到L浓溶液,则G为H2O、L为HNO3 , D系列转化得到黄绿色气体为Cl2 , 结合转化关系及元素守恒可推知B为NH4Cl,气体C与F反应得到G,可推知C为H2 , 非金属单质H与浓硝酸反应得到G、I、K,且金属A可以在I中燃烧得到H,可推知H为碳、I为CO2 , A为Mg,结合转化关系可知D为MgCl2 , (1)由上述分析可知,B的化学式为NH4Cl,电子式为  ,I为CO2 , 为直线形结构,所以答案是:
,I为CO2 , 为直线形结构,所以答案是:  ;直线形;(2)反应②为:反应方程式为:2Mg+CO2
;直线形;(2)反应②为:反应方程式为:2Mg+CO2 ![]() 2MgO+C,现象为:燃烧,发光发热,有黑色与白色固体物质生成,所以答案是:燃烧,发光发热,有黑色与白色固体物质生成;(3)操作a是由氯化镁溶液得到氯化镁晶体,由于溶液中镁离子水解得到氢氧化镁与HCl,必须在HCl气流中加热得无水物,而不能直接加热浓缩,其原因是抑制Mg2+的水解;操作b是电解熔融的氯化镁得到Mg与氯气,所以答案是:抑制Mg2+的水解;熔融状态下电解;(4)反应①的离子反应方程式为为:Mg+2NH4+═Mg2++H2↑+2NH3↑,反应③的化学反应方程式为:4NH3+5O2
2MgO+C,现象为:燃烧,发光发热,有黑色与白色固体物质生成,所以答案是:燃烧,发光发热,有黑色与白色固体物质生成;(3)操作a是由氯化镁溶液得到氯化镁晶体,由于溶液中镁离子水解得到氢氧化镁与HCl,必须在HCl气流中加热得无水物,而不能直接加热浓缩,其原因是抑制Mg2+的水解;操作b是电解熔融的氯化镁得到Mg与氯气,所以答案是:抑制Mg2+的水解;熔融状态下电解;(4)反应①的离子反应方程式为为:Mg+2NH4+═Mg2++H2↑+2NH3↑,反应③的化学反应方程式为:4NH3+5O2 ![]() 4NO+6H2O,所以答案是:Mg+2NH4+═Mg2++H2↑+2NH3↑;4NH3+5O2
4NO+6H2O,所以答案是:Mg+2NH4+═Mg2++H2↑+2NH3↑;4NH3+5O2 ![]() 4NO+6H2O;(5)已知氢气的燃烧热为286 kJ/mol,1g 氢气为0.5mol在氧气中完全燃烧生成液体水,放出的热量为134kJ,热化学反应方程式:
4NO+6H2O;(5)已知氢气的燃烧热为286 kJ/mol,1g 氢气为0.5mol在氧气中完全燃烧生成液体水,放出的热量为134kJ,热化学反应方程式: ![]() H2(g)+
H2(g)+ ![]() O2(g)=
O2(g)= ![]() H2O(g)△H=﹣143kJ/mol,所以答案是:
H2O(g)△H=﹣143kJ/mol,所以答案是: ![]() H2(g)+
H2(g)+ ![]() O2(g)=
O2(g)= ![]() H2O(g)△H=﹣143kJ/mol.
H2O(g)△H=﹣143kJ/mol.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素.
(1)氧元素基态原子核外未成对电子数为个.
(2)①H2O分子内的O﹣H键、②分子间的范德华力和③氢键从强到弱依次为(填序号即可) .
(3)对羟基苯甲醛的沸点比邻羟基苯甲醛高,理由是 .
(4)H+可与H2O形成H3O+ , H3O+中O原子采用杂化轨道.H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸(  )是一种抗氧化药物,存在如图转化关系.
)是一种抗氧化药物,存在如图转化关系. 
(1)绿原酸中的含氧官能团有:酯基、 .
(2)B的分子式是 .
(3)C的氧化产物能发生银镜反应,则C→D的化学方程式是 .
(4)咖啡酸苯乙酯的结构简式是 .
(5)F是A的同分异构体.F分别与碳酸氢钠溶液或新制Cu(OH)2反应产生气体或红色沉淀;苯环上只有两个取代基,且核磁共振氢谱表明该有机物中有8种不同化学环境的氢.①符合上述条件的F有种可能的结构.
②若F还能与NaOH在常温下以物质的量之比1:2完全反应,其化学方程式是(任写1个).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:含C=C的物质(烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A﹣D间存在图示的转化关系. 
下列说法不正确的是( )
A.D结构简式为CH3COOCH2CH3
B.A能使酸性高锰酸钾溶液褪色
C.B与乙酸发生了取代反应
D.可用B萃取碘水中的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述或操作中正确的是( )
A.稀释浓硫酸时,将浓硫酸沿着量筒壁慢慢的注入盛有水的量筒中,并不断搅拌
B.浓硫酸具有氧化性,稀硫酸无氧化性
C.浓硫酸不慎沾到皮肤上,应立即用布拭去,再用大量的水冲洗
D.浓硫酸与铜反应中,被氧化和被还原的物质的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为:r(y)>r(x)>r(z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生下图所示变化,其中B和C均为10电子分子。下列说法不正确的是

A. X元素位于ⅥA
B. A不能溶解于B中
C. B的沸点高于C的沸点
D. A和C不可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液的体积比是3:2:1,则三溶液中氯离子的物质的量浓度之比为
A. 3 :4 :3B. 1 :2 :3C. 1 :1 :1D. 6 :3 :2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为﹣2价.如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( ) 
A.超氧化钾的化学式为KO2 , 每个晶胞含有4个K+和4个O2﹣
B.晶体中每个K+周围有8个O2﹣ , 每个O2﹣周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com