
【题目】下列叙述或操作中正确的是( )
A.稀释浓硫酸时,将浓硫酸沿着量筒壁慢慢的注入盛有水的量筒中,并不断搅拌
B.浓硫酸具有氧化性,稀硫酸无氧化性
C.浓硫酸不慎沾到皮肤上,应立即用布拭去,再用大量的水冲洗
D.浓硫酸与铜反应中,被氧化和被还原的物质的物质的量之比为1:2
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E 均为中学化学常见物质,它们之间的转化关系如图所示(部分产物略去,①②③④的反应条件相同).则A、E 可能的组合为( ) 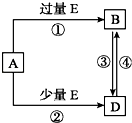
①CO2、NaOH 溶液 ②NaCl溶液、Ca(OH)2 溶液③Fe、稀HNO3 ④Na、O2 ⑤CuO,C ⑥AlCl3 溶液、NH3H2O.
A.②③④⑤
B.①③④⑤⑥
C.①②③⑤⑥
D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+ , 其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( ) 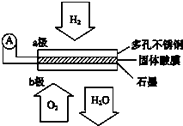
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e﹣=4OH﹣
C.每转移0.1mol电子,消耗标准状况下1.12 L的H2
D.OH﹣由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列实验操作中错误的是( )
A. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B. 加热试管内物质时,试管底部与酒精灯灯芯接触
C. 过滤时,玻璃棒在引流过程中应放在三层滤纸处
D. 称量时,称量物放在称量纸上,置于托盘天平左盘,砝码直接放在托盘天平右盘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入4mol SO2和3mol O2 一定条件下建立平衡2SO2(g)+O2(g)═2SO3(g)△H=﹣Q KJ/mol,测得SO2的转化率为90%,则在此条件下,反应放出的热量为( )
A.1.8Q KJ
B.2Q KJ
C.Q KJ
D.0.9Q KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体.有关物质间的转化关系如图(图中部分反应物或产物已省略):
请填空:
(1)B的电子式为;I分子的空间构型为 .
(2)反应②的实验现象为 .
(3)操作a必须在HCl气流中加热得无水物,其原因是;操作b为 .
(4)反应①的离子反应方程式为;反应③的化学反应方程式为 .
(5)已知C的燃烧热为286 kJ/mol,请写出表示1g C在F中完全燃烧生成液体G的热化学反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同物质的量的CO和CO2,下列比较正确的是( )
①所含的分子数目之比为1:1 ②所含的氧原子数目之比为1:1
③所含的原子总数目之比为2:3 ④摩尔质量之比为7:11
A. ①②B. ②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:
(1)Y元素在周期表中的位置为 .
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入的物质名称是负极电极反应式为 .
(3)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W溶液吸收生成一种盐.该盐水溶液pH7(填“大于”、“小于”或“等于”),其原因是(用离子方程式表示):该溶液中所有离子浓度大小顺序为 .
(4)试写出实验室制取C的化学方程式 . 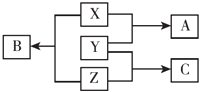
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图1所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯.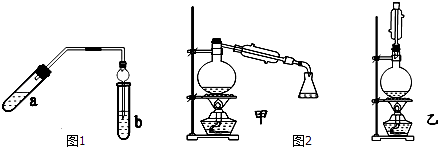
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式: .
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是 , 步骤⑤中分离乙酸乙酯必须使用的一种仪器是 .
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图A所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18molL﹣1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 | |
C | 3mL乙醇、2mL乙酸、6mL 3molL﹣1 H2SO4 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和molL﹣1 .
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 .
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 .
④分离出乙酸乙酯层后,经过洗涤杂质;为了干燥乙酸乙酯可选用的干燥剂为(填字母) .
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
⑤为充分利用反应物,该同学又设计了图2中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为更合理的是 . 理由是: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com