
����Ŀ��������(HNO2)��һԪ���ᣬ���ȶ���ֻ�ܴ����ڽϵ��¶ȵ�ϡ��Һ�С�����ʱ��������(HNO2)�ĵ���ƽ�ⳣ��Ka=5.1��10-4��H2CO3�ĵ���ƽ�ⳣ��Ka1=4.2��10-7��Ka2=5.61��10-11�������ἰ������ʵ���ҵ����������ҪӦ�á���ش�
(1)�����������£�NaNO2��KI�����ʵ���1�U1ǡ����ȫ��Ӧ��I��������ΪI2��д���÷�Ӧ�����ӷ���ʽ________________��
(2)NaNO2��Һ��_____��(����������������������)��ԭ����________(�����ӷ���ʽ��ʾ)��Ҫ�õ��ȶ�HNO2��Һ���������䶳��ŨNaNO2��Һ�м����ͨ��ij�����ʣ��������ʲ��ʺ�ʹ��______(�����)��
a.ϡH2SO4 b.CO2 c.SO2
(3)���õ�ⷨ����ˮ��NO2��ת��ΪN2��ȥ��N2����__________(��缫����)���ɡ�
(4)��1 mol Na2CO3����Һ�м���1 mol HNO2��c(CO32-)��c(HCO3-)��c(NO2��)�ɴ�С��˳��Ϊ________________��
(5)25��ʱ����0.100molL-1NaOH��Һ�ζ�20.0mLijŨ�ȵ�HNO2��Һ����Һ��pH��NaOH��Һ���(V)�Ĺ�ϵ��ͼ��ʾ��(�ڸ�������HNO2���ֽ�)
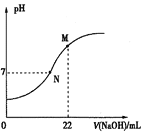
��֪��M���Ӧ��Һ�У�c(OH��)=c(H+)+c(HNO2)����
��ԭ��Һ��c(HNO2)Ϊ_________��
�����й���N���Ӧ��Һ��˵����ȷ����______(��ѡ����ĸ)��
A.����ֻ��NaNO2
B.ˮ���������c(H+)=1��10-7 molL-1
C.��Һ�У�c(Na+)��c(OH-)
D.��Һ������Ũ�ȣ�c(Na+)= c(NO2-)
���𰸡�4H+ + 2NO2��+ 2I��=I2 + 2NO��+ 2H2O �� NO2��+H2OOH��+ HNO2 bc ���� c(NO2��)> c(HCO3-) > c(CO32-) 0.110mol/L BD
��������
(1)����������ԭ��Ӧ�е�ʧ�����غ��жϺ�N���������д���ӷ���ʽ��
(2)���ݸ��ֽⷴӦ��ǿ���������ԭ���Լ�������ԭ��Ӧ��ԭ���жϣ�
(3)�����У����������õ��ӵĻ�ԭ��Ӧ����������ʧ���ӵ�������Ӧ��
(4)�����ж϶��߷�Ӧ�IJ���ٽ��Խ��Խˮ���ԭ��������
(5)�ٸ���M���Ӧ��Һ�У�c(OH��)=c(H+)+c(HNO2)���ж�M��ǡ������NaNO2���ݴ˼���c(HNO2)��
��N����Һ�����ԣ�NaOH���㣬HNO2��ʣ�࣬����ΪNaNO2��HNO2���ݴ˷������
(1)I��������ΪI2ʱ��1mol I��ʧ����1mol��NaNO2��NԪ�ػ��ϼ���+3�ۣ����������������£�NaNO2��KI�����ʵ���1�U1ǡ����ȫ��Ӧ���ɵ�ʧ�����غ��֪1molNaNO2�õ���1mol����NԪ�ػ��ϼ�Ӧ����Ϊ+2�ۣ�������к���������ΪNO����ƽ�����ӷ���ʽΪ4H+ + 2NO2��+ 2I��=I2 + 2NO��+ 2H2O���ʴ�Ϊ��4H+ + 2NO2��+ 2I��=I2 +2NO��+2H2O��
(2)NaNO2Ϊǿ�������Σ�NO2������ˮ��NO2��+H2OOH��+ HNO2��ʹ��Һ�ʼ��ԣ���֪����ʱ��������(HNO2)�ĵ���ƽ�ⳣ��Ka=5.1��10-4��H2CO3�ĵ���ƽ�ⳣ��Ka1=4.2��10-7�������ԣ�HNO2��H2CO3������ǿ���������ԭ����֪��NaNO2��������̼��ˮ���ܷ�Ӧ����HNO2����(1)֪�����������£�NaNO2�ܽ�I������ΪI2����ŨNaNO2��Һ��ͨ���������ʱ��NaNO2�ܽ��������������������õ�HNO2������ϡH2SO4���������ֽⷴӦ����HNO2���ʴ�Ϊ���NO2��+H2OOH��+ HNO2��bc��
(3)�õ�ⷨ����ˮ��NO2��ת��ΪN2��ȥ��NԪ�ػ��ϼ۽��ͣ��õ��ӣ����ݵ��ص�ԭ�������������õ��ӵĻ�ԭ��Ӧ����N2�����������ɣ��ʴ�Ϊ��������
(4)���ԣ�HNO2��H2CO3������1 mol Na2CO3����Һ�м���1 mol HNO2��������Ӧ��Na2CO3+ HNO2=NaHCO3+ NaNO2�������ʱ�Ϊ1mol NaHCO3��1molNaNO2���������ԣ�HNO2��H2CO3������Խ��Խˮ��ԭ��֪��NO2����ˮ��̶ȱ�HCO3����ˮ��̶�С���������ӵ�ˮ�������ģ�HCO3���ĵ��������ģ���c(CO32-)��c(HCO3-)��c(NO2��)�ɴ�С��˳��Ϊc(NO2��)>c(HCO3��) > c(CO32��)���ʴ�Ϊ��c(NO2��)>c(HCO3��) > c(CO32��)��
(5)����֪��M���Ӧ��Һ�У�c(OH��)=c(H+)+c(HNO2)����M��ǡ������NaNO2���ɴ˿�֪��22mL 0.100molL-1NaOH��20.0mL HNO2��Һǡ�÷�Ӧ����ɵ�c(NaOH)V(NaOH)=c(HNO2)V(HNO2)��0.022L��0.100molL-1=0.020Lc(HNO2)�����c(HNO2)=0.110mol/L���ʴ�Ϊ��0.110mol/L��
��N����Һ�����ԣ�NaOH���㣬HNO2��ʣ�࣬����ΪNaNO2��HNO2��
A. ����ΪNaNO2��HNO2��A�����
B. N����Һ�����ԣ�ˮ���������c(H+)=1��10-7 molL-1��B����ȷ��
C. N����Һ�����ԣ�����ΪNaNO2��HNO2��c(Na+)Զ����c(OH-)��C�����
D. N����Һ�����ԣ��ɵ���غ㣺



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ1��2��ʾ��װ�ã�����������ȷ����( )


ͼ1 ͼ2
A.����ϩ�ֱ�ͨ������װ���У����߶���ɫ��ԭ����ͬ
B.��ij�������ʹ������ɫ��˵��������һ������ϩ
C.���߶������ڳ�ȥ�����л��е���ϩ
D.���߶������ڼ����������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ĽṹΪ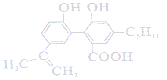 ������˵����ȷ���ǣ� ��
������˵����ȷ���ǣ� ��
A. 1 mol���л�����������7 mol H2�����ӳɷ�Ӧ
B. ���л�����Է���ȡ�����ӳɡ�������ˮ��ȷ�Ӧ
C. 0.1 mol���л��������������Ʒ�Ӧ����������3.36L H2
D. ����л��������ͬ�����ŵ�ͬ���칹�干��8�֣������������칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I��һ�ֿ���ȱѪҩ��ϳ�·�����£�
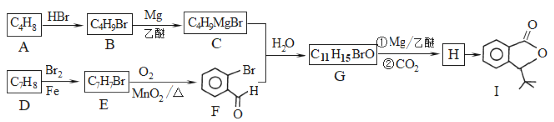
��֪��
�ش��������⣺
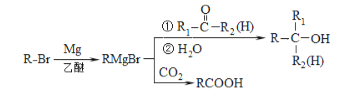
(1)����ϵͳ��������A��������_____��д��A�����Ӿ۷�Ӧ�Ļ�ѧ����ʽ��__________��
(2)��ӦH��I�Ļ�ѧ����ʽΪ________����ӦE��F�ķ�Ӧ������______��
(3)д����������������G������ͬ���칹��Ľṹ��ʽ��________
����FeCl3��Һ������ɫ��Ӧ �ں˴Ź���������4���
(4)��,��-�����д�(![]() )�Ǻϳ�ҽҩ��ũҩ���м��壬�Ա���2-�ȱ���Ϊ��ʼԭ���Ʊ���,��-�����д��ĺϳ�·�����£�
)�Ǻϳ�ҽҩ��ũҩ���м��壬�Ա���2-�ȱ���Ϊ��ʼԭ���Ʊ���,��-�����д��ĺϳ�·�����£�

�úϳ�·����X�Ľṹ��ʽΪ____��Y�Ľṹ��ʽΪ________���Լ�������2Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������Ԫ��A��B��C��D��E��F��ԭ��������������AԪ�صĻ�̬�����ӵĵ����Ų�ʽ���̬����ӵ���ͬ��A��Eλ��ͬ���壬��̬Bԭ�Ӻ�����3���ܼ��Ҹ��ܼ������ɵĵ�������ȣ���̬Dԭ�Ӻ�����2��δ�ɶԵ��ӣ������ܲ����ΪL��+1��F���ӵ�3d�ܼ��ﵽȫ�����ṹ��
�ش��������⣺
(1)��̬Cԭ�Ӽ۵����Ų�ͼΪ_________��
(2)B��C��D����Ԫ�ص�һ�������ɴ�С����Ϊ____(��Ԫ�ط��ţ���ͬ)�����ǵĵ縺����С��������Ϊ____��
(3)��״���£�a L C2���庬���������ʵ���Ϊ__����C2D��Ϊ�ȵ�����ķ�����___(��дһ��)��B��C�ֱ���D���ɵ��������У����幹��Ϊƽ�������ε���___(�����ӷ���)��
(4)��A��B��C��D�еļ���ԭ�ӹ��ɵķ����У������Լ��ķǼ��Է�����___(��һ�֣���ͬ)���Ⱥ����Լ����ֺ��Ǽ��Լ��ļ��Է�����___��
(5)C��F��ɵľ���ľ�����ͼ��ʾ����֪�þ����ܶ�Ϊ�� g��cm-3��NA���������ӵ�������ֵ����C��F����ĺ˼��Ϊ____ pm��
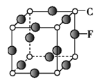
(6)A��E��ɾ��壬�侧����ͼ��ʾ��E������Χ��___��E���������������������E���ӵȾ����������A���ӹ��ɵ���״��_____��
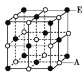
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н����̻���ʵ�ķ���ʽ����ȷ����( )
A.������������ˮ������Cl2+H2O��HCl+HClO
B.�����Ժ�ϡ���ᷴӦ��2Fe+3H2SO4��Fe2(SO4)3 +3H2��
C.����ӡˢ��·��ʱ�����Ȼ�����Һ��Ϊ����ʴҺ����ʴͭ�� 2Fe3++Cu��2Fe2++ Cu2+.
D.���ȵ���˿��ˮ�Ӵ��������γ�����ɫ(���ɫ)�����㣺3Fe + 4H2O(g)![]() Fe3O4 + 4H2
Fe3O4 + 4H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.������ͨʽΪCnH2n+2����nֵ����̼Ԫ�ص������ٷֺ�����С
B.��ϩ����ˮ�����ӳɷ�Ӧ�IJ���Ϊ������
C.1mol��ǡ����3mol������ȫ�ӳɣ�˵��һ����������������̼̼˫��
D.C7H16����������5��̼ԭ�ӵ�ͬ���칹�干��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ܱ������м���0.6 mol A��0.2 mol C��һ������B�������塣һ�������·�����Ӧ��������Ũ����ʱ��仯���ͼ��ʾ[����t0-t1��c(B)δ����]��t2ʱ�̺�ı�������Ӧ��ϵ�з�Ӧ������ʱ��仯���������ͼ��ʾ�����ĸ��ζ����ı�һ���������Ҹı������������ͬ������˵����ȷ���ǣ� ��
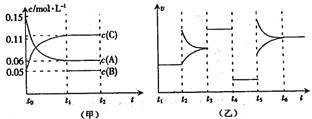
A.��Ӧ�ķ���ʽΪ3A(g)+B(g) ![]() 2C(g)
2C(g)
B.t3~t4��t4~t5��t5~t6���ο��ܸı����������Ϊ���Ӵ��������ͷ�Ӧ�¶ȣ�����ѹǿ
C.B����ʼ���ʵ���Ϊ0.08 mol
D.��t1=10 s��A��t0~t1ʱ��εķ�Ӧ����Ϊ0.00225 mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���������ֻ�����Ӧ���ͣ�������������ԭ��Ӧ���ǣ� ��
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl��+NaNO3
C.Fe2O3+3CO2![]() Fe+3CO2
Fe+3CO2
D.2KMnO4![]() K2MnO4MnO2+O2��
K2MnO4MnO2+O2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com