
在固态金属氧化物电解池中,高温并电解H2O-CO2混合气体(1:1)制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是
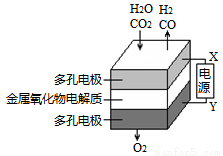
A、X是电源的负极
B、阴极的反应式是:H2O+2e-==H2+O2-;CO2+2e-==CO+O2-
C、总反应可表示为:H2O+CO2 H2+CO+O2
H2+CO+O2
D、阴、阳两极生成的气体的物质的量之比是1:1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届四川省成都市高三上学期期中考试化学试卷(解析版) 题型:填空题
I.H2A在水中存在以下平衡:H2A H+ +HA- ,HA-
H+ +HA- ,HA- H++A2- 。
H++A2- 。
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为____________________。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是_______________。
A.c(Na+ )>c(K+) B.c(H +)•c(OH)=1×10-14
C.c(Na+ )=c(K+) D.c(Na+ )+c(K+ )=c(HA-)+c(A2- )
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+ (aq)+A2- (aq),滴加少量Na2A固体,c(Ca2+ )_______________(填“增大”、“减小”或“不变”),原因是________________。
Ca2+ (aq)+A2- (aq),滴加少量Na2A固体,c(Ca2+ )_______________(填“增大”、“减小”或“不变”),原因是________________。
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含4.00×10-3 mol/L的Cr2O72-。为使废水能达标排放,作如下处理:
(1)该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_______________。
(2)欲使25 L该废水中Cr2O7 转化为Cr3+,理论上需要加入__________g FeSO4·7H2O。
(3)若处理后的废水中残留的c(Fe)=1×10-13mol/L,则残留的 Cr3+ 的浓度为__________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol/L,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.摩尔是国际七个基本物理量之一
B.摩尔质量等于相对分子质量或相对原子质量
C.标准状况下,任何气体的摩尔体积都约为22.4L
D.1mol某种微粒含有的微粒数等于0.012kg12C所具有的碳原子数
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期期中联考化学试卷(解析版) 题型:选择题
下表各组物质中,物质之间不可能实现如图 所示转化的是
所示转化的是
选项 | X | Y | Z | M |
A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
C | NH3(g) | NO | NO2 | O2 |
D | S(s) | SO2 | SO3 | O2 |
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三上学期统练(三)化学试卷(解析版) 题型:填空题
电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是 。
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN) = C(OH-) D.C(HCN)+ C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理________________________________ 。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;质子守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO +H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
+H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师范大学附属中学高三上学期期中考试化学试卷(解析版) 题型:选择题
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:
CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法不正确的是( )
A.检测时,电解质溶液中的H+向正极移动
B.若溶液中有0.4 mol电子通过,则在标准状况下消耗4.48 L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2==CH3COOH+H2O
D.正极上发生的反应为:O2+4e-+4H+=2H2O
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中考试化学试卷(解析版) 题型:选择题
CuO、Fe粉、Fe3O4的混合物中,加一定量稀硫酸,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,片刻后.取出铁钉,观察现象。以下结论中正确的是( )
A.若铁钉部分溶解,则滤液中一定含Fe2(SO4)3
B.若铁钉完全溶解,则滤液中一定含CuSO4
C.若铁钉表面有红色物质生成,则不溶物中一定不含Fe
D.若铁钉无变化,则不溶物中一定含Fe
查看答案和解析>>
科目:高中化学 来源:2016届浙江宁波效实中学高三上学期期中考试化学试卷(解析版) 题型:推断题
原子序数依次增大的A、B、C、D、E五种短周期元素,可以两两形成多种原子个数比为1:1的化合物,其中的甲、乙、丙、丁4种化合物有两种属于离子化合物。A、B的原子序数之和是元素D的一半。B既是组成蛋白质的必要元素,也是某些化肥的组成元素。只有C为金属元素,焰色反应呈黄色。请回答下列问题:
(1)元素E 的原子结构示意图为 。
(2)B和D形成的化合物甲,其相对分子质量在170~190之间,且D的质量分数约为70%,则该化合物的化学式为 。
(3)A和B形成的化合物乙为B4A4,在一定条件下可以电离出两种离子,其中一种为10e-的离子,该物质一定条件下的电离方程式为 。
(4)化合物C2D溶液在空气中长期放置会变质生成丙C2D2,用化学方程式表示该过程 。
(5)D和E形成的化合物丁中所有原子均满足8电子稳定结构,该化合物的电子式为 ;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,已知X是能使品红褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为 。
某研究小组同学为确定干燥的X和Y混合气体中Y 的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案 (填“正确”或“不正确”),理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com