
【题目】根据要求填空:
(1)写出下列有机物的键线式: 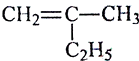
(2)写出有机物  的名称
的名称
(3)写出甲基电子式: , 乙炔的结构式
(4)某有机高分子化合物的结构片段如下:
则合成它的单体是
【答案】
(1)![]()
(2)2,3,5-三甲基-4-乙基庚烷
(3)![]() ;H-C≡C-H
;H-C≡C-H
(4)CH2=CHCN、CH2=CH-CH=CH2、CH2=CH2
【解析】(1) 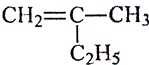 用键线式表示为:
用键线式表示为: ![]() ;
;
(2)有机物 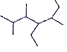 主链有7个碳,三个甲基,一个乙基,它的名称为2,3,5-三甲基-4-乙基庚烷;
主链有7个碳,三个甲基,一个乙基,它的名称为2,3,5-三甲基-4-乙基庚烷;
(3)甲烷分子中去掉一个氢原子后剩下的一价基团.由碳和氢元素构成.—CH3 , 甲基电子式 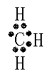 ;乙炔有一个叁键它的结构式H-C≡C-H;
;乙炔有一个叁键它的结构式H-C≡C-H;
(4)某有机高分子化合物的结构片段中,链节主链中只有碳原子,并存在碳碳双键结构的高聚物,为二烯烃与烯烃的加聚产物,按如图: 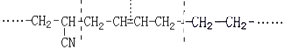 所示断键后,再将两个半键闭合,可得合成它的单体是CH2=CHCN、CH2=CH-CH=CH2、CH2=CH2。
所示断键后,再将两个半键闭合,可得合成它的单体是CH2=CHCN、CH2=CH-CH=CH2、CH2=CH2。
故答案为:(1)![]() ;(2)2,3,5-三甲基-4-乙基庚烷;(3)
;(2)2,3,5-三甲基-4-乙基庚烷;(3)![]() ;H-C≡C-H;(4)CH2=CHCN、CH2=CH-CH=CH2、CH2=CH2
;H-C≡C-H;(4)CH2=CHCN、CH2=CH-CH=CH2、CH2=CH2
(1)键线式中,起点、拐点、终点,表示碳原子;键线式中,无需体现氢原子;
(2)根据系统命名法进行烷烃的命名;
(3)根据电子式的书写规则书写;
(4)根据加聚反应的特征进行分析,确定聚合物的单体。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】了解有机物分子中化学键特征以及成键方式是研究有机物性质的基础。下列关于有机物分子的成键方式的描述不正确的是( )
A. 烷烃分子中碳原子均采用sp3杂化轨道成键
B. 炔烃分子中碳碳叁键由1个σ键、2个π键组成
C. 甲苯分子中所有碳原子均采用sp2杂化轨道成键
D. 苯环中存在6个碳原子共有的大π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表物质与其所含化学键类型、所属化合物类型不正确的一组是( )
选 项 | A | B | C | D |
物 质 | Na2O2 | H2O | HCl | NaCl |
所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键 |
所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 离子化合物 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硫的化合物在生产生活中的应用非常广泛。
(1)用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-566.0 kJ·mol-1
2CO2(g) ΔH2=-566.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
则2H2(g)+SO2(g)![]() S(g)+2H2O(g) ΔH4=__________。
S(g)+2H2O(g) ΔH4=__________。
(2)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
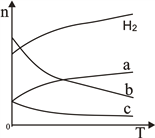
①该反应为____反应(填“吸热”或“放热”)。
②曲线c表示的物质为____________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________【要求答2条】。
④恒温恒容下,能够说明该反应已达到平衡的是_______(填序号);
A.容器内的压强不发生变化
B.混合气体的密度不发生变化
C.n(CO2):n(H2):n(C2H4):n(H2O)=2:6:1:4
D.单位时间内生成6molH2,同时生成4 molH2O
(3)欲用1 L Na2CO3溶液将6.99gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________________。(忽略溶液体积的变化)[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液液呈中性,则氨水的电离平衡常数Kb=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 欲实现铁上镀锌,用锌作阴极
B. 电解精炼铜,若转移2mol电子,阴极质量增加64g
C. 硫酸工业中采用沸腾炉以增大固气接触面积,加快反应速率
D. 镁的提取工业中,MgCl2·H2O在HCl气流中脱水以防止MgCl2水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是以空气、海水中的物质为原料制取纯碱的工业流程:
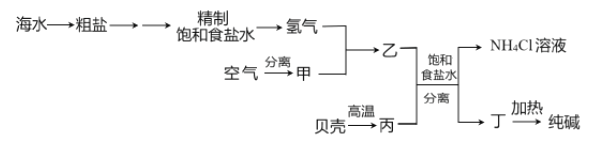
已知粗盐中含有Ca2+、Mg2+、SO42-等杂质离子。下列有关说法不正确的是
A. 除去粗盐中的杂质离子可依次加入NaOH溶液、BaCl2溶液、Na2CO3溶液
B. 甲、丙分别为N2、CO2
C. 分离得到丁和NH4Cl溶液的操作是过滤
D. 上述流程中物质转化有涉及置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用某浓度的NaOH溶液滴定20.00mL等浓度的CH3COOH溶液,所得滴定曲线如下图。下列说法正确的是
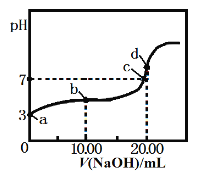
A. a点醋酸的浓度为1.0×10-3mol·L-1
B. a、b两点对应的醋酸电离平衡常数:a<b
C. c点c(Na+):c(CH3COO-)=1:1
D. d点溶液升高温度,溶液pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方案错误的是( )
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | C2H5OH(l) | H2O(l) | 新制的生石灰 | 蒸馏 |
B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
C | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
D | NaCl(s) | Na2CO3(s) | 盐酸 | 蒸发 结晶 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关石墨晶体的说法正确的是( )
A. 由于石墨晶体导电,所以它是金属晶体
B. 由于石墨的熔点很高,所以它是原子晶体
C. 由于石墨质软,所以它是分子晶体
D. 石墨晶体是一种混合晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com