
(16分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g)≒CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
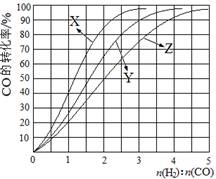
|
A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将 (填“增大”、“减 小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
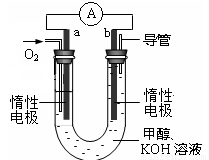
①该电池工作时,OH-向 极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池负极反应式为 , 电池总反应的离子方程式为 。
(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H =-443.5kJ·mol-1
(2)X ; B (3)① > ② 增大
(4)① b ② CH3OH - 6e-+ 8OH-=CO32- + 6H2O
2CH3OH + 3O2 + 4OH-=2CO32- + 6H2O
【解析】(1)考查盖斯定律的应用。根据反应①CO(g)+1/2O2(g)=CO2(g)和反应②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)可知,②-①×2即得到2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l),所以反应热是-1453.0kJ/mol+283.0 kJ/mol×2=-887 kJ/mol。
(2)因为反应是放热反应,所以温度越高,转化率越低。因此根据图像可判断曲线X表示的是230℃。同样根据图像可判断,n(H2):n(CO) 的比值范围在2.5~3时,转化率最高,所以答案选B。
(3)①根据方程式可知当氢气浓度是0.5mol/L时,生成物CO2的浓度也是0.5mol/L。消耗水蒸气和CO的浓度都是0.5mol/L,则剩余水蒸气和CO的浓度分别是0.5mol/L和1.5mol/L。此时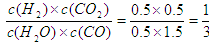 <1,所以反应向正反应方向移动,即正反应速率大于逆反应速率。
<1,所以反应向正反应方向移动,即正反应速率大于逆反应速率。
②正反应是放热反应,降低温度,平衡向正反应方向移动,平衡常数增大。
(4)原电池中负极失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。在该燃料电池中,正极通入氧气,负极通入甲醇,所以a是正极,b是负极。电解质是碱性溶液,所以负极电极反应式为CH3OH - 6e-+ 8OH-=CO32- + 6H2O,电池总反应式为2CH3OH + 3O2 + 4OH-=2CO32- + 6H2O。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
(16分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1molCO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。氢气的转化率为 。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵工业上也可以用CO和H2合成甲醇,反应原理为:CO(g)+2H2(g)CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的同时不断充入氢气,使H2的浓度保持不变,则平衡 ;
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断
作出此判断的理由是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省焦作市高二上学期期末考试化学试卷 题型:填空题
(16分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。氢气的转化率为 。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升 高温度 B.充入He(g),使体系压强增大
高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵工业上也可以用CO和H2合成甲醇,反应原理为:CO(g)+2H2(g) CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的
CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的 同时不断充入氢气,使H2的浓度保持不变,则平衡 ;
同时不断充入氢气,使H2的浓度保持不变,则平衡 ;
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断
作出此判断的理由是 。
查看答案和解析>>
科目:高中化学 来源:2012届河南省焦作市高二上学期期末考试化学试卷 题型:填空题
(16分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
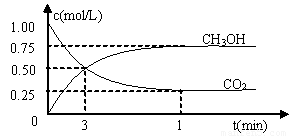
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。氢气的转化率为 。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵工业上也可以用CO和H2合成甲醇,反应原理为:CO(g)+2H2(g) CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的同时不断充入氢气,使H2的浓度保持不变,则平衡
;
CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的同时不断充入氢气,使H2的浓度保持不变,则平衡
;
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断
作出此判断的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
近期“问题奶粉”引起了人们的极大关注。其问题主要是奶粉中掺杂了三聚氰胺,三聚氰胺性状为纯白色晶体,无味,密度1.573克/厘米3 (16℃)。常压下熔点为354℃(分解),快速加热升华,升华温度为300℃;微溶于冷水,易溶于热水、醚、苯和四氯化碳,可溶于甲醇、乙酸、热乙二醇等。
(1)三聚氰胺的结构简式如下图所示的环状物,则三聚氰胺的分子式为_________该物质的含氮量为 ,三聚氰胺为三个氰胺分子加聚而成,已知氰胺分子中除H原子外,C、N 原子的最外层均达8个电子的结构,则氰胺的电子式为_______________, 三聚氰胺和相对分子质量相近的硝基苯比较 (无色或微黄色具苦杏仁味的油状液体。相对分子质量为123.11;熔点5.7℃。沸点210.9℃)。三聚氰胺的熔点特殊的高,其原因是______________________________。

(2)下列关于三聚氰胺的说法中,正确的有________________(填序号,多选扣分);
A. 三聚氰胺是一种含氮量高的白色结晶,无味,所以掺入奶粉后不易被发现
B. 三聚氰胺分子中所有原子一定在同一个平面上
C. 三聚氰胺易溶于冷水,属于分子晶体
D. 三聚氰胺呈弱碱性,可以与酸反应
E. 采用三聚氰胺制造的食具一般都会标明“不可放进微波炉使用”
(3)乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。不法分子通过在低蛋白含量的奶粉中加入三聚氰胺来“提高”奶粉中的蛋白质含量,导致许多婴幼儿肾结石。假定奶粉中蛋白质含量为16%即为合格,不法分子在一罐总质量为500g、蛋白质含量为0的假奶粉中掺入了________g的三聚氰胺就可使奶粉“达标”(小数点后保留1位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com